3.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是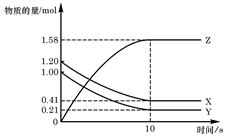
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
| B.反应开始时10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始时10s,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g)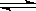 Z(g) Z(g) |
下列有关AgCl沉淀的溶解平衡的说法中,正确的是
| A.升高温度,AgCl的溶解度减小 |
| B.在任何含AgCl固体的水溶液中,c(Ag+)=c(Cl-)且二者乘积是一个常数 |
| C.AgCl沉淀生成和溶解不断进行,但速率相等 |
| D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解的质量不变 |
下列溶液中离子浓度关系的表示正确的是
| A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) |
| B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)+c(CH3COO-) |
| C.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-) |
25℃时,水的电离达到平衡:H2O H++OH- ΔH>0,下列叙述正确的是
H++OH- ΔH>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
室温下,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,当混合溶液的pH=10时,强酸和强碱的体积之比为
| A.1∶9 | B.9∶1 | C.10∶1 | D.1∶10 |
常温下的下列溶液,有关说法正确的是
A.某酸H2A的钠盐NaHA溶液中:c(A2-) < c(H2A),则该溶液的pH>7
B.1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0
C.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
D.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同