某校化学兴趣小组将用剩的过氧化氢溶液倒入放有生锈铁钉的废液缸中,发现产生了大量的气泡,经检验此气体为氧气。根据学过的知识初步判断,是生锈铁钉中的某种物质加快了过氧化氢的分解,那么究竟是哪种物质加快了过氧化氢的分解速率?请你参与他们的研究,分享和体验探究实验的快乐。
【猜想与假设】
甲同学:铁钉表面的氧化铁加快了H2O2的溶液分解。
乙同学:铁钉里的 加快了H2O2的溶液分解。
【设计方案和实验】完成下列表格
| 实验方案 |
实验现象 |
结论 |
| 方案一:向盛有10mL 5% H2O2溶液的试管中加入2g 氧化铁粉末,将一根带火星的木条放在试管口,观察现象。 |
|
甲同学结论成立。 |
| 方案二:向盛有10mL 5% H2O2溶液的试管中加入 粉末,将一根带火星的木条放在试管口,观察现象。 |
无现象 |
乙同学结论 。 (填“成立”或“不成立”) |
【讨论交流】丙同学认为“方案一”只能说明Fe2O3加快了H2O2溶液的分解,并不能说Fe2O3就一定是催化剂。你是否支持丙同学的观点? ,如果要证明氧化铁是催化剂,就要设计一个实验来证明,这个实验的设计原理是 。
【拓展】
(1)实验证明Fe2O3粉末可以作为H2O2分解的催化剂。该反应的文字表达式
(2)下表是丙同学探究影响H2O2分解速率时所记录的部分数据,通过对数据分析,你能得出什么结论? 。
用足量等体积H2O2溶液制取相同体积O2所需的时间: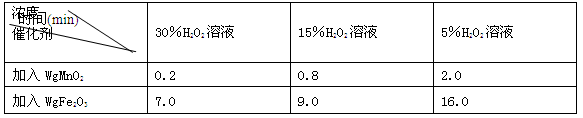
(10盐城2. 18).(1)请回答下列有关水的问题:
①自来水生产过程中先用的方法除去水中不溶性杂质,再进行消毒。X是一种常见的自来水消毒剂,工业上制取X的化学方程式为: Cl2+2NaClO2=2NaCl+2X,则X的化学式是▲。
②地下水硬度过大会影响生产和生活,应软化后使用。
a.检验硬水常用的是物质是。
b.如果某地地下水钙、镁离子含量过高(假设主要以CaCl2、MgCl2形式存在),可先加入适量的熟石灰,反应的化学方程式为▲,再加入适量的纯碱后生成沉淀,即可将水软化。
③我市不少村镇小型河沟中藻类疯长,说明水体富营养化,你认为造成该现象的原因可能有▲(正确选项有多个,请选填字母序号)。
A.化学肥料流失到河中 B.排放的生活污水中有含磷洗涤剂
C.人畜的粪便流失到河中 D.工业废水的排放
④爱护水资源从我做起,下列做法可行的有▲(正确选项有多个,请选填字母序号)。
A.洗脸、刷牙时随时关闭水龙头 B.用洗菜、洗衣的水冲厕所、拖地
C.用洗衣机洗一两件衬衫 D.用残茶水浇灌某些花卉
(2)有机物A在氧气中燃烧后只生成二氧化碳和水,为确定A的组成,某同学进行了如下探究。
【猜想】
猜想一:A中只含C、H两种元素
猜想二:A中含C、H、O三种元素
【实验】
【结论】猜想▲正确(选填“一”或“二”)。
【反思】有机物A中所含元素的质量比为▲。
(10汕头23)(14分)2010年4月28日某媒体题为“排污工程施工,毒气放倒三人”的报道,引起某兴趣小组同学的思考。
【提出问题】排污管道中的毒气有什么成分?
【查阅资料】
I.排污管道中的大部分有机物在一定条件下发酵会产生CO、CO2、H2S、CH4等。
Ⅱ.H2S气体能与CuSO4溶液反应生成黑色沉淀。
【提出猜想】小组同学对排污管道气含有上述气体中最少3种成分的猜想如下:
猜想1:有CO、CO2、H2S;猜想2:有CO、CO2、CH4;
猜想3:有CO、H2S、CH4;猜想4:有CO2、H2S、;
猜想5:有CO、CO2、H2S、CH4。
【实验方案】小组同学共同设计了下图所示的装置并进行探究(夹持仪器已省略)。
【问题讨论】
(1)如果A装置没有明显变化,则猜想成立;
如果B装置没有明显变化,则猜想成立。
(2)在验证猜想l的实验中,装置C中NaOH溶液的作用是;若要进一步验证气体燃烧后的产物,操作是:迅速把烧杯倒过来,向烧杯内注入 ,振荡。(3)要确证猜想5中是否有CH4,某同学认为图示装置有不足之处,需要在装置C与D之间加一个装置。改进后,若气体燃烧,且D装置内壁出现,证明气体中一定含有CH4。
为了进一步确定气体中是否含有CO,可分别测定燃烧产物中H2O、CO2的质量。其方法是:将燃烧产物依次通过盛有、的装置,分别称量吸收燃烧产物前、吸收燃烧产物后装置的质量,通过计算、分析得出结论。
(10乐山44)小明在家中探究食用白醋的性质,选用了家庭生活中的下列常见物品:200ml的软透明塑料瓶、食品干燥剂、白醋、鸡蛋壳、紫罗兰花、锈铁钉、蒸馏水、纯碱、玻璃小杯。
【 问题 】
白醋是否具有酸类的性质?
【查阅资料】
(1)白醋为无色透明液体,其主要成分是醋酸,化学式可表示为HAc, Ac—代表醋酸根;
(2)食品干燥剂的主要成分是氧化钙;
(3)紫罗兰花遇酸变为红色;
(4)醋酸盐中除银盐和汞盐外都易溶解于水。
【探究与验证】(请你帮助填写表中空白)
| 实验序号 |
实验操作 |
实验现象 |
实验结论 |
| 一 |
将白醋滴在紫罗兰花上 |
紫罗兰花变红 |
白醋的pH7 |
| 二 |
将锈铁钉放在小玻璃杯中,加入白醋 |
刚开始时 ,一段时间后,有气泡冒出 |
1.白醋能与铁锈反应 2. |
| 三 |
向软塑料瓶中加入10ml白醋,将瓶捏扁,加入约5g鸡蛋壳,拧紧瓶盖 |
瓶中有气泡冒出,扁塑料瓶逐渐膨胀 |
白醋能与碳酸钙反应放出CO2 |
| 四 |
向白醋中加入纯碱 |
白醋中有气泡冒出 |
白醋能与碱反应 |
【反思与评价】
(1)小明将干燥剂袋口打开一段时间后,袋中的白色颗粒粘在了一起,请写出变化的化学方程式。
(2)上面“实验结论”中,错误的是(填实验序号)。
(3)上述实验三的现象还不足以得出表中所述的相应结论,为此还需要补充相应的实验,写出该实验发生反应的化学方程式。
下图是利用CO、CO2混合气体中的CO还原CuO的实验示意图。
①仪器a的名称是。乙装置中应该用酒精灯的焰加热。
②写出甲中反应的化学方程式:;
乙装置的仪器b中黑色粉末变红时发生反应的化学方程式:。
③反应过程中,丙中可观察到的实验现象是。
④该装置存在的主要问题是。
⑤实验结束后,要从甲装置的混合溶液中回收得到较纯净的NaOH固体。
资料显示,在不同温度下NaOH的溶解度如下:
| 温度(℃) |
10 |
20 |
40 |
60 |
80 |
100 |
| 溶解度(g/100g水) |
64 |
85 |
138 |
203 |
285 |
376 |
利用实验室的试剂和条件,实验步骤如下(其中Ⅰ、Ⅱ、Ⅲ为实验操作):
请具体填写试剂A的化学式以及实验操作Ⅰ、Ⅱ、Ⅲ的名称。
化学式:A;
操作名称ⅠⅡⅢ
(10四川甘孜25)实验室有一瓶长时间放置的氢氧化钠溶液,试剂瓶口处有白色粉末状固体,小明同学感到很好奇,对白色粉末可能的成分进行了猜想:①可能含有氢氧化钠;②可能含有碳酸钠。
(1)小明同学得出猜想②的理由是:。(用化学方程式表示)
(2)小明同学取白色粉末少许,加稀盐酸有气泡产生,证明白色粉末中一定含有。
该反应的化学方程式:。
(3)小明同学想证明白色粉末中还含有氢氧化钠,于是取少量白色粉末溶于水,滴入酚酞溶液,酚酞变红,因此小明同学认为一定含有氢氧化钠,你认为对吗?,(填“对”或“不对”)你的理由是。