2010年全国人大和政协会议使了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
| |
烧杯① |
烧杯② |
烧杯③ |
烧杯④ |
烧杯⑤ |
| 加入样品的质量/g |
10 |
10 |
10 |
10 |
10 |
| 加入稀盐酸的质量/g |
10 |
20 |
30 |
40 |
50 |
| 充分反应后生成气体的质量/g |
0.88 |
1.76 |
X |
3.52 |
3.52 |
(1)表中X的值为 ;
(2)碳酸钙恰好完全反应时消耗稀盐酸 g;
(3)求样品中碳酸钙的质量分数为多少?
某厂排放的废水中含有碳酸钠,易造成环境污染。化学兴趣小组为该厂设计废水处理和利用的方案.讲行了如下实验:取过滤后的水样200
,逐滴加入稀盐酸至恰好不再产生气体为止,反应过程中生成气体与所加稀盐酸的质量关系如图所示。请回答下列问题(不考虑水样中杂质的影响):
(I)反应生成
气体的质量是
;
(2)反应后生成氯化钠的质量是多少?(写出计算过程)
(3)农业上常用10%一20%的氯化钠溶液来选种。请通过列式计算判断:上述实验反应后所得溶液能否直接用于农业上选种?
在实验室里加热
氯酸钾(
)和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为
。请计算:
(1)生成氧气的质量为
;
(2)原混合物中氯酸钾的质量。
盐水选种是我国古代劳动人民发明的一种巧妙的挑选种子的方法。农业生产上常用质量分数为15%-20%的氯化钠溶液来选种。
(1)要配制200
18%的氯化钠,计算应称取氯化钠的质量。
(2)选种进行一段时间后,农技员估计溶液和溶质质量分数都有所减少,他取出45
氯化钠溶液,加入过量的
溶液,得到沉淀14.35
,计算氯化钠溶液中溶质的质量分数。
(反应原理为:
↓相对原子质量
-23
-14
-16
-l35.5
-108)
小丽同学取铜和氧化铜的混合物m g置于烧杯中,并向烧杯中逐滴加入稀硫酸溶液,不断搅拌,测得烧杯中溶液的质量与加入稀硫酸的质量关系如图所示。求: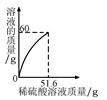
(1)m g混合物中,氧化铜的质量是_______克;
(2)当加入51.6g稀硫酸溶液时恰好完全反应,此时溶液中溶质的质量分数。
经研究发现,在人们喜爱的腌制食品中含有致癌物质N-二甲基亚硝胺[化学式为(CH3)2NNO],该物质是由________种元素组成的,其中氮元素的质量分数为______(计算结果保留一位小数)。