在“质量守恒定律”的课堂教学中,甲、乙两组同学进行了“化学反应中,反应物与生成物的质量关系”的实验探究。实验装置和选用药品如图所示: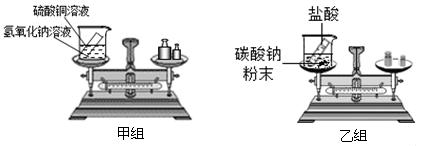
(提示:CuSO4+2NaOH==Na2SO4+Cu(OH)2↓;2HCl+Na2CO3==2NaCl+H2O+CO2↑)
(1)根据实验目的,两组同学应该测量的数据是_____________(填“只有反应前”“只有反应后”“反应前、后”之一)整个反应装罝(包括烧杯、试管和药品)的质量。
(2)实验过程中他们都进行了规范的操作、准确的称量和细致的观察:
| |
现象 |
结论 |
| 甲组 |
出现蓝色沉淀,天平平衡 |
质量守恒 |
| 乙组 |
出现大量气泡,天平不平衡 |
质量不守恒 |
乙组实验反应后天平不平衡,天平指针向 偏转(填“左”或“右”)。你认为结论正确的是 (填“甲组”或“乙组”),而导致另一组结论错误的原因是 。
(3)由质量守恒定律可知,化学反应前后,一定不变的是 。(填序号)
①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质种类
原子序数11—17元素的符号和原子结构示意图如下,请结合下图回答:
⑴原子序数为15的原子质子数为_______最外层有______电子;
⑵结合上图用符号表示下列内容:
①原子序数为13的原子形成的离子符号____________,
②分子中含有两个原子物质的化学式_____________,
③原子序数为12、17的元素组成化合物的化学式_______________。
⑶从11—17,随着原子序数的增加,其原子结构(或元素的性质)呈现出的变化规律是:________________________________________。(任写一条)
用数字与符号表示:(1)4个氟原子(2)3个铁离子 (3)4个铵根离子(4)2个二氧化硫分子(5)硫化钠
(3)4个铵根离子(4)2个二氧化硫分子(5)硫化钠
(6)正三价铝元素(7)(8)3个氩分子
下图为某元素在周期表中的信息及原子结构示意图,阅读后回答下列问题:
(1)该元素名称是,符号相对原子质量为是(填金属元素或非金属
元素)最外层电子数为形成的离子的符号
(2)根据H在第一周期,O在第二周期,Na在第三周期,推此元素在周期。
(3)此元素与1—20内的元素(填元素符号)的化学性质相似,该元素与H元素形成化合物的化学式为。
如图是在一容器中的某个化学反应前、后物质的微观模拟图,请根据图示回答: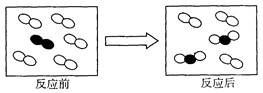
(1)该反应属于反应。
(2)反应前两物质在一起属于(选填“纯净物”或“混合物” )。
(3)若 表示氢气,
表示氢气, 表示氧气,请用化学方程式表示该反应过程:;
表示氧气,请用化学方程式表示该反应过程:;
液晶是一类新型材料,广泛地用于电子、仪表产品等。MBBA是其中一种研究较多的液晶材料,化学式为C18H21NO。
(1)MBBA中含有种元素,1个MBBA分子中含有个原子。
(2)MBBA的相对分子质量为。