某不纯的碳酸钠固体样品,含有的杂质可能是NaNO3、CaCO3、CuSO4、NaCl四种物质中的一种或几种。为确定其杂质的成分,进行了如下实验:
试根据实验过程和发生的现象填写以下空白:
(1)常温下,气体C的水溶液的pH_______7(填“大于”“小于”“等于”之一)。
(2)操作1的名称是__________。
(3)根据上述实验,证明样品中,一定不存在的物质是(写化学式)_______________。
(4)根据上述实验,已经证明了溶液B中存在的物质有(写化学式)_________。
(5)仅根据上述实验现象,还不能确定是否混入样品中的物质是_____________。
(6)写出生成白色沉淀A反应的化学方程式____________________________________。
“对比实验”是化学实验中重要的实验。小明同学进行了如图所示的A与B的对比实验。
①B中反应的文字表达式。
②B实验中的实验现象是________________________。
③小明同学通过A与B的对比实验可得知的结论是。
写出下列元素符号,氧,氯
写出下列数字的意义①25Na②Mg2+
己知电子的质量约为质子(或中子)质量的 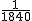 ,下表是几种原子的组成和它们的相对原子质量.通过此表可总结出如“同一原子中质子数=核外电子数”等结论,请你再总结出两条规律:
,下表是几种原子的组成和它们的相对原子质量.通过此表可总结出如“同一原子中质子数=核外电子数”等结论,请你再总结出两条规律: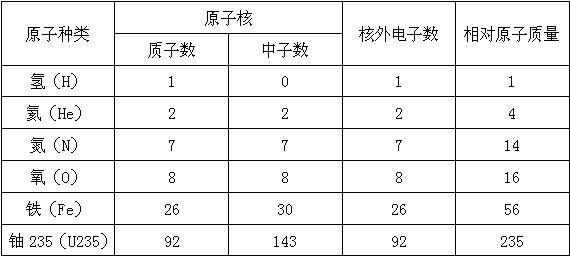
①
②
原子排布规律(1)金属元素原子的最外层电子数一般4,容易(填“失电子”或“得电子”),非金属元素原子的最外层电子数大于或等于4,容易(填“失电子”或“得电子”)
(2)稀有气体元素原子的最外层电子数8个(除氦原子2个电子外)