我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)△H=﹣23.5kJ•mol﹣1,该反应在1000℃的平衡常数等于64。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
2Fe(s)+3CO2(g)△H=﹣23.5kJ•mol﹣1,该反应在1000℃的平衡常数等于64。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g) CH3OH(g),请根据图示回答下列问题:
CH3OH(g),请根据图示回答下列问题: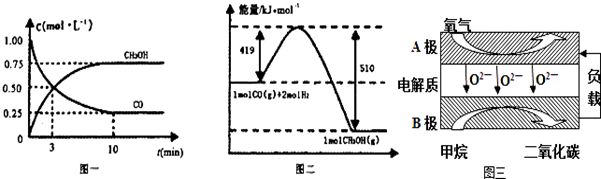
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= 。
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
| 甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是( )
A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α1+α2=1
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图三是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
(1)B极上的电极反应式为
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下)。
(6分)A、B、C、D、E、F、G均为短周期元素,它们在周期表中的位置如图所示。
请按要求回答下列问题。
| A |
|||||||
| D |
E |
||||||
| B |
C |
F |
G |
(1)A单质的收集方法为。
(2)上述元素形成的单质中,还原性最强的是(填写元素符号)。
(3)E元素是非金属性最强的元素,其阴离子的结构示意图是。
(4)F、G元素的最高价氧化物对应水化物的酸性强弱顺序是(填化学式)。
(5)B元素的最高价氧化物对应水化物与C元素的最高价氧化物对应水化物相互间反应的化学方程式是。
将下列物质进行分类:
①10B与11B ②O2和O3 ③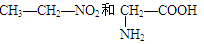
④C60和金刚石 ⑤冰和水 ⑥CH3—CH2—OH和CH3—O—CH3 ⑦ 1H+ 和2H—
(1)互为同位素的是_________(2)互为同素异形体的是____________
(3)互为同分异构体的是___________(4)属于同一化合物的是____________
(I)将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。试回答下列问题: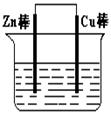
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的极,可观察到Cu棒上产生现象是,试用电极反应式表示该现象:。
(2)若电解质为硫酸铜溶液,则Cu棒上发生反应(填“氧化”“还原”),Zn棒上发生反应的电极反应式为:。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为:。
(II)A、B、C三个烧杯中分别盛有500mL相同物质的量浓度的稀硫酸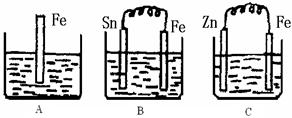
(1)写出A中离子反应方程式:
(2)一段时间后,B中Sn极附近溶液的pH(填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了5.6L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为
(4)反应完成后三个烧杯中液体质量大小顺序为:ABC (用<、=、>连接)。
A、B、C、D、E五种短周期元素,原子序数按A、B、C、D、E依次增大,A元素原子失去1个电子后变为质子,B元素原子的最外层电子数比次外层电子数多2个, C元素原子的最外层电子数是次外层电子数的3倍,D元素原子最外层电子数为1,E元素原子的最高价与负价的绝对值之差为4。试回答:
(1)E元素在元素周期表中的位置是
(2)由A、C二种元素共同组成的化合物中既含极性键又含非极性键的是,
只含极性键的是(填化学式)。
(3)D与E可形成化合物,用电子式表示该化合物
(4)用电子式表示B、C两元素形成稳定化合物的过程
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)该反应的化学方程式为。
(2)反应开始至2min,以气体Z表示的平均反应速率为。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时____________(填“增大”“减小”或“相等”)。