下列溶液中含Cl﹣物质的量浓度最大的是
| A.1mL 0.1mol•L﹣1的氯化铝溶液 |
| B.10mL 0.1mol•L﹣1的氯化钙溶液 |
| C.30mL 0.2mol•L﹣1的氯化钾溶液 |
| D.40mL 0.25mol•L﹣1的氯化钠溶液 |
工业上由二氧化锰制备高锰酸钾可分两步进行,第一步:二氧化锰与氢氧化钾共熔并通入氧气:2MnO2+4KOH+O2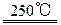 2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+2H2O
2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+2H2O 2KMnO4+H2↑+2KOH,下列说法正确的是( )
2KMnO4+H2↑+2KOH,下列说法正确的是( )
| A.氧化性:KMnO4>K2MnO4>O2 |
| B.根据上述过程,每生成1 mol KMnO4共转移6 mol电子 |
| C.第二步电解时,KMnO4在阳极区生成 |
| D.第二步电解时,阴极周围pH减小 |
关于电解NaCl水溶液,下列叙述正确的是( )
| A.电解时在阳极得到氯气,在阴极得到金属钠 |
| B.若在阳极附近的溶液中滴入KI溶液,溶液呈现棕色 |
| C.若在阴极附近的溶液中滴入酚酞试液,溶液呈现无色 |
| D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈现中性 |
用惰性电极电解未精制的饱和食盐水,食盐水装在U形管内,结果很快在某一电极附近出现食盐水变浑浊现象。造成浑浊的难溶物主要是( )
| A.碳酸镁 | B.硫酸钡 | C.氢氧化镁 | D.碳酸钡 |
用惰性电极进行电解,下列说法正确的是( )
| A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2 |
| D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1 |
硫酸工业可以用黄铁矿、硫磺或石膏为原料,其中以石膏为原料时必须和生产水泥结合起来。一种工艺是以石膏为原料先制得SO2,下列说法正确的是…()
| A.用石膏制SO2的反应是一个还原反应 |
| B.SO2转化为SO3是体积减小的可逆反应,为提高转化率,工业上一般采取加压 |
| C.水泥工业要用纯碱为原料 |
| D.《京都议定书》的签订对以上的硫酸生产方式没有影响 |