已知强酸与强碱反应的中和热为—57.3KJ/mol,请写出硫酸溶液与氢氧化钠溶液反应的中和热的热化学方程式 。
元素周期表是人们研究物质性质的重要工具,下表是元素周期表的一部分,请用化学用语回答下列问题: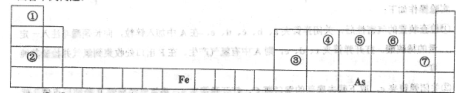
(1)①—⑦号元素原子半径最大的是____,最高价氧化物对应的水化物物酸性最强的是________________.
(2)写出由①-⑦号元素中的几种组成显碱性的盐的化学式____________________。(写出2种即可),并用离子方程式表示其中一种显碱性的原因____________________.
(3)写出③号元素的最高价氧化物与①-⑦号元素中金属性最强的元素的最高价氧化物的水化物反应的离子方程式_____________________。
(4) As在元素周期表中的位置是________________。
(5)As的原子结构示意图为________,其氢化物的电子式为___________.
(6)Y是由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂。As可以与Y的水溶液反应,生成其最高价含氧酸(H3AsO4 ),写出该反应的离子方程式_____________________,
当消耗1mol还原剂时转移电子的物质的量为______________________。
(14分)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为_________________________________________________。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是______________________________________。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是___________________________________。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。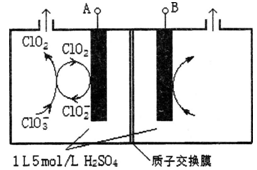
①电源负极为_______极(填A或B):
②写出阴极室发生反应依次为:________________、____________________________;
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2﹣歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为______________。
(14分)尽管氮元素在地壳中的丰度较低(主要以硝酸盐的形式存在),在所有元素中仅排31位,但是大气中有丰富的氮气,这为氨和硝酸的广泛应用提供了可能。
(1)氮气的电子式为_______,雷电作用能进行氮的固定,写出反应方程式______________。
(2)食物蕴含的营养物质中,含氮的高分子化合物是______________ (填名称),其水解的最终产物为______________。
(3)土壤中的NH4+在硝化细菌的催化作用下可转化为NO3﹣,写出其离子方程式: ______________。
(4)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2 L,再向溶液中加入过量氨水,充分反应后过滤。①滤液显深蓝色是因为含有的离子(填化学式).______________。②若沉淀质量为7.8g,则合金的质量为______________g。
(10分)已知铜能被稀硝酸溶解,其反应的化学方程式如下
3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应的电子转移情况(只需标出电子得失的方向和数目)
__________________________________________________________________。
(2)上述反应中氧化剂是,氧化产物是。
(3)上述反应中氧化剂与还原剂的物质的量之比为。
(4)若反应中转移了0.6 mol电子,产生的气体在标准状况下的体积是。
(10分)
(1)0.5molCH4的质量是g,在标准状况下的体积为L;含有约个氢原子。
(2)将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为;配制300 mL 0.5 mol·L-1氯化钠溶液,需要1.5 mol·L-1的氯化钠溶液的体积是mL。