在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是
| A.反应后溶液中Fe3+物质的量为0.8 mol |
| B.反应后产生13. 44 L H2(标准状况) |
| C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol |
| D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
下列说法错误的是
| A.实验室制取蒸馏水和用海水晒盐都利用了相同的物质分离方法 |
| B.往盛有少量淀粉溶液的试管中加入一定量稀硫酸,加热3~4分钟后,再加入NaOH溶液至碱性,最后加入银氨溶液并水浴加热,有“银镜”出现 |
| C.受强碱腐蚀致伤时,应先用大量水冲洗,再用2%的醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 |
| D.采用比色的方法测定溶液颜色的深浅,根据溶液颜色与反应物浓度的关系,可换算成反应物在不同反应时刻的浓度 |
下列说法错误的是
| A.二氧化碳和环氧丙烷在催化剂作用下可生成一种可降解的高聚物 |
| B.化石燃料的燃烧和含硫金属矿石的冶炼等都是造成SO2污染的重要原因 |
| C.H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
| D.氟氯烃的大量使用会破坏臭氧层,火箭、导弹将大量废气排放到高空,也会加速臭氧分解 |
某溶液中仅含有以下离子中的五种(不考虑水的电离和离子的水解),且各离子的物质的量浓度相等。阳离子:Na+、Mg2+、Fe2+、Al3+、Fe3+;阴离子:OH-、CO32-、Cl-、NO3-、SO42-。下列说法正确的是
| A.溶液中肯定不存在。的离子是Na+和CO32- |
| B.用氢氧化钠溶液可以确定阳离子的组成 |
| C.溶液中加入稀硫酸,有气体产生 |
| D.溶液中存在的Cl-,可用硝酸酸化的硝酸银溶液检验 |
已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
| A.b点的操作是拉伸注射器 |
| B.d点:v(正)< v(逆) |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
已知阴离子交换膜只允许阴离子通过。某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入下图所示的装置中进行电解。下列说法中不正确的是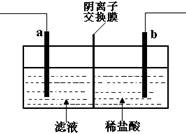
| A.电解时,电极a应与外电源的正极相连 |
| B.电解时,电极b周围产生无色无味的气体 |
| C.电解时,电极a发生的反应是:2Cl――2e-= Cl2↑ |
| D.电解时,可以用氯化钠溶液替代稀盐酸 |