浓盐酸和Ca(ClO)2能发生反应:Ca(ClO)2+ 4HCl = CaCl2+ 2H2O + Cl2↑,用久置漂白粉和浓盐酸反应得到的氯气中,可能含有的杂质气体是①CO2,②HCl,③H2O,④O2
A.①②③ B②③④ C②③ D①④
在密闭容器中发生反应:mA(g)+nB(g) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是 ( )
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是 ( )
| A. m+n〈p | B.平衡向逆反应方向移动 |
| C. A的转化率降低 | D. C的体积分数增加 |
反应N2O4(g) 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )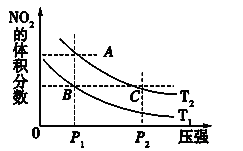
A.A、C两点的反应速率:A>C
B.B、C两点的反应速率:B=C
C.A、C两点混合气体的平均相对分子质量:A>C
D.由状态B到状态A,可以用加热的方法
在某温度下,可逆反应mA(g) + nB(g)  pC(g) + qD(g)的平衡常数为K,下列说法正确的是( )
pC(g) + qD(g)的平衡常数为K,下列说法正确的是( )
| A.增加A的量,平衡正向移动,达到新平衡时K值增大 |
| B.升高温度,K值增大 |
| C.K越大,说明该反应的进行程度越大,转化率越高 |
D.该反应的K=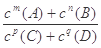 |
已知4NH3+5O2 4NO+6H2O,若化学反应速率分别是用v(NH3)、v(O2)、v(NO)、v(H2O)〔单位:mol·(L·s)-1〕表示,则正确的关系是( )
4NO+6H2O,若化学反应速率分别是用v(NH3)、v(O2)、v(NO)、v(H2O)〔单位:mol·(L·s)-1〕表示,则正确的关系是( )
| A. 4/5 V(NH3) = V(O2) | B. 5/6 V(O2) = V(H2O) |
| C. 2/3 V(NH3) = V(H2O) | D. 4/5 V(O2) = V(NO) |
氯原子对O3分解有催化作用:O3+Cl ="==" ClO+O2 ΔH1 ; ClO +O ="==" Cl +O2 ΔH2大气臭氧层的分解反应是:O3+ O===2O2 ΔH,该反应的能量变化如图: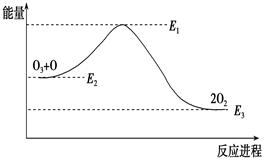
下列叙述中,正确的是( )
| A.反应O3 + O ="==" 2O2的ΔH=E1-E3 |
| B.O3 + O ="==" 2O2是吸热反应 |
| C.ΔH=ΔH1+ΔH2 |
| D.大气层中的臭氧无法再生 |