实验室用0.10mol/L的NaOH溶液滴定某一元弱酸HA的滴定曲线如图所示。图中横轴为滴入的NaOH溶液的体积V(mL),纵轴为溶液的pH。下列叙述不正确的是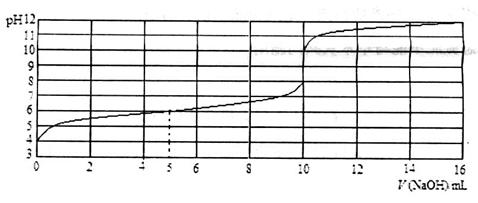
A.此一元弱酸HA的电离平衡常数Ka≈1×10-6mol/L
B.此弱酸的起始浓度约为1×10-2mol/L
C.此实验最好选用酚酞试液(变色范围8.0~10.0)做指示剂
D.当混合液pH=7时,溶液中c(HA)>c(A—)
下列说法正确的是
A.2013年4月,国家药监局批准抗H7N9流感的新药帕拉米韦(结构如图) 上市,该药品分子中含有氨基、羧基、羟基、醛基等官能团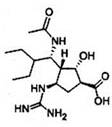 |
| B.液化石油气、汽油、沥青和石蜡的主要成分都是碳氢化合物 |
| C.工业上均用电解熔融金属氯化物的方法来冶炼金属Na、Mg、Al |
| D.铜氨纤维、聚酯纤维、醋酸纤维和硝化纤维都可由纤维素制得,均属于有机高分子材料 |
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的化学方程式为:KI+3H2O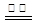 KIO3+3H2↑。下列有关说法不正确的是
KIO3+3H2↑。下列有关说法不正确的是
| A.电解时,石墨作阳极,不锈钢作阴极 |
| B.电解时的阳极电极反应式:I-−6e-+3H2O = IO3-+6H+ |
| C.当电解过程中转移3 mol e-时,理论上可制得KIO3 107 g |
| D.电解一段时间后,电解质溶液的pH变小 |
下列说法正确的是
A.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH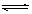 CH3COO-+H+,加少量烧碱溶液可使溶液中 CH3COO-+H+,加少量烧碱溶液可使溶液中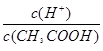 值增大。 值增大。 |
B.25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O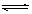 H++OH-逆向移动,c(H+)降低 H++OH-逆向移动,c(H+)降低 |
| C.取c(H+)="0.01" mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-) |
下列说法正确的是
A.某有机物含有C、H、O、N四种元素,其球棍模型为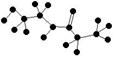 。该有机物的结构简式为
。该有机物的结构简式为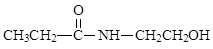
B.按系统命名法,化合物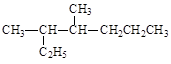 的名称为3-甲基-2-乙基己烷
的名称为3-甲基-2-乙基己烷
C.七叶内酯( )和东莨菪内酯(
)和东莨菪内酯(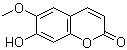 )都是某些中草药中的成分,它们具有相同的官能团,互为同系物
)都是某些中草药中的成分,它们具有相同的官能团,互为同系物
D.S-诱抗素的结构简式为: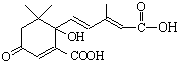 ,则1 mol S-诱抗素与氢氧化钠溶液反应时,最多消耗3 mol NaOH
,则1 mol S-诱抗素与氢氧化钠溶液反应时,最多消耗3 mol NaOH
原子序数依次增大的X、Y、Z、M、W为五种短周期元素。已知Y与Z、M与W分别同周期,X与M同主族; X、Z、M的质子数之和等于Y、W的质子数之和;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76 g·L-1;Y、M、W的最高价氧化物的水化物,两两间都能发生反应。下列说法不正确的是
A.M的单质可用于从钛、锆等金属的氯化物中制备钛、锆等单质
B.只含X、Y、Z三种元素的某水溶液,可能呈碱性或酸性
C.由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同
D.含有W阳离子的某些盐,可用作净水剂