已知短周期主族元素X、Y、Z、W、R,其中X的原子半径在短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层L层电子数为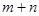 ,M层电子数为
,M层电子数为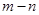 ,W与Z同主族,R元素原子与Y元素原子的核外电子数之比为2:l。下列叙述错误的是
,W与Z同主族,R元素原子与Y元素原子的核外电子数之比为2:l。下列叙述错误的是
| A.X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 |
| B.Z、W、R最高价氧化物对应水化物的酸性:R>W>Z |
| C.RY2、WY2通入BaCl2溶液中均有向色沉淀生成 |
| D.Y的氢化物比R的氢化物稳定,且熔沸点高 |
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):NN为942、OO为500、NN为154,则断裂1 mol NH键所需的能量(kJ)是( )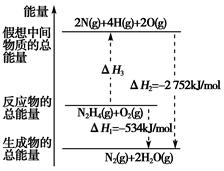
| A.194 | B.391 | C.516 | D.658 |
如图所示,图像表示某一反应过程中的能量变化曲线。下列说法中不正确的是( )
| A.由图可知,该反应为放热反应 |
| B.该反应的焓变为ΔH=-(E2-E1) |
| C.曲线b相对曲线a来说,改变的条件只能是使用了催化剂 |
| D.该反应的发生条件一定是加热 |
下列有关能量的判断或表示方法正确的是( )
| A.由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ·mol-1,可知:石墨比金刚石更稳定 |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 |
| C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) |
ΔH=-285.8 kJ·mol-1
化学与社会、环境等密切相关。下列说法错误的是( )
| A.“低碳经济”是指减少对化石燃料的依赖,达到低污染、低排放的模式 |
| B.“低碳生活”倡导生活中耗用能量尽量减少,从而减少CO2的排放 |
| C.所有垃圾都可以采用露天焚烧或深埋的方法处理 |
| D.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2 +O2↑。下列对此反应的说法中,不正确的是( )
+O2↑。下列对此反应的说法中,不正确的是( )
| A.方框中的物质为Na2SO4 |
| B.Na2O2既是氧化剂,又是还原剂 |
| C.Na2FeO4既是氧化产物,又是还原产物 |
| D.2 mol FeSO4发生反应时,反应中共转移8 mol电子 |