已知反应:2CO(g)+O2(g) 2CO2(g)△H<0。某温度下,将2 mol CO和1 mol O2置于10 L密闭容器中,反应达平衡后,CO的平衡转化率(
2CO2(g)△H<0。某温度下,将2 mol CO和1 mol O2置于10 L密闭容器中,反应达平衡后,CO的平衡转化率( )与体系总压强(p)的关系如图甲所示。则下列说法正确的是
)与体系总压强(p)的关系如图甲所示。则下列说法正确的是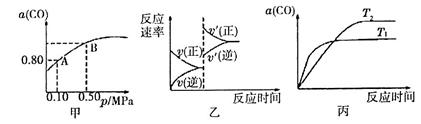
A.由图甲知,A点CO的平衡浓度为0.4 mol |
| B.由图甲知,B点CO、O2、CO2的平衡浓度之比为2:l:2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D.若0.50 MPa时不同温度下CO转化率与温度关系如丙图,则T2>T1 |
A、B、C三种醇同足量的金属钠完全反应,相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则三种醇分子里的羟基数之比为( )。
A.3∶2∶1 B.2∶6∶2
C.3∶1∶2 D.2∶1∶3
下列选项中能说明乙醇(酒精)作为燃料的优点是( )。
①燃烧时发生氧化反应
②充分燃烧的产物不污染环境
③乙醇是一种再生能源
④燃烧时放出大量热
| A.①②③ | B.①②④ |
| C.①③④ | D.②③④ |
乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )。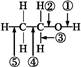
| A.和金属钠反应时①键断裂 |
| B.在铜催化及加热条件下与O2反应时断裂①键和③键 |
| C.在铜催化及加热条件下与O2反应时断裂①键和⑤键 |
| D.在空气中完全燃烧时断裂①②③④⑤键 |
下列物质最难电离出H+的是( )。
| A.CH3COOH | B.C2H5OH | C.H2O | D.H2CO3 |
禁止使用工业酒精配制料酒,这是因为酒精中常含有少量会使人中毒的( )。
| A.甲醇 | B.乙醇 | C.油脂 | D.丙醇 |