下列叙述中正确的是
| A.向体积为Va的0.02 mol·L-1 CH3COOH溶液中加入体积为Vb的0.02 mol·L-1 NaOH溶液,Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(Na+) |
| B.将0.2 mol·L-1的盐酸与0.1 mol·L-1的KAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-) |
| C.pH=5的HCOOH溶液和pH=5的NH4NO3溶液中,c(H+)不相等 |
| D.25 ℃时,pH=4,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
工业合成氨的反应是在500℃左右进行,主要原因是()
| A.500℃时反应速率最快 |
| B.500℃时的平衡浓度最大 |
| C.500℃时的转化率最高 |
| D.500℃时催化剂能发挥最大效力 |
在3H2 + N2 2NH3反应中,使用催化剂的理由是()。
2NH3反应中,使用催化剂的理由是()。
| A.使平衡向正反应方向移动 | B.没有催化剂该反应不能发生 |
| C.使化学反应速率增大 | D.遏止逆反应的发生 |
可逆反应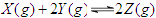 (正反应为吸热反应),为了有利于Z的生成,应采用的反应条件是()
(正反应为吸热反应),为了有利于Z的生成,应采用的反应条件是()
| A.高温高压 | B.高温低压 | C.低温高压 | D.低温高压 |
下列有关合成氨工业的途述,可用勒沙特列原理来解释的是()
| A.使用铁触媒,使N2和H2混合气体有利于合成氨 |
| B.高压比常压条件更有利于合成氨的反应 |
| C.5000C左右比室温更有利于合成氨的反应 |
| D.合成氨时采用循环操作,可提高原料的利用率 |
在合成氨时,可以提高H2转化率的措施是()
| A.延长反应时间 | B.充入过量H2 | C.充入过量N2 | D.升高温度 |