含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如图所示:
)的废水可以利用微生物电池除去,其原理如图所示:
| A.B极是正极 |
| B.B极是阳极 |
| C.每转移2mol电子,有1molCH3COO-被氧化 |
D.A极电极反应式为: |
反应N2O4(g)  2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是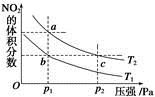
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a深、c浅 |
| C.a、b两点气体的平均相对分子质量:a>b |
| D.b、c两点化学平衡常数:b<c |
下列表格中的各种情况,可以用如图所示曲线表示的是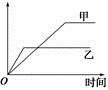
| 选项 |
反应 |
纵坐标 |
甲 |
乙 |
| A |
相同质量的氨气,在同一容器中发生反应:2NH3 N2+3H2 N2+3H2 |
氨气的转化率 |
500 ℃ |
400 ℃ |
| B |
等质量的钾、钠分别与足量的水反应 |
H2的质量 |
钠 |
钾 |
| C |
在体积可变的恒压容器中,体积之比为1∶3的N2、H2:N2+3H2 2NH3 2NH3 |
氨气的浓度 |
活性高的催化剂 |
活性一般的催化剂 |
| D |
2 mol SO2和1 mol O2在相同温度下发生反应:2SO2+O2 2SO3 2SO3 |
SO3的物质的量 |
2个大气压 |
10个大气压 |
已知(CH3COOH)2(g)  2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量 随温度(T)的变化曲线如图所示,下列说法正确的是( )
随温度(T)的变化曲线如图所示,下列说法正确的是( )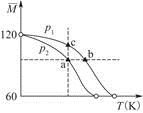
| A.该过程的ΔH<0 |
| B.气体压强:p(a)<p(b)=p(c) |
| C.平衡常数:K(a)=K(b)<K(c) |
| D.测定乙酸的相对分子质量要在高压、低温条件 |
在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g) 3C(g)+D(s) ΔH1>0,②xM(g)+N(g)
3C(g)+D(s) ΔH1>0,②xM(g)+N(g) 3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。
3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。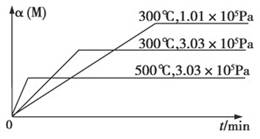
下列对W容器中进行的反应推断合理的是
A.反应①一定是自发反应,反应②一定是非自发反应
B.若容器内温度保持不变,则v正(B):v逆(C)=2:3
C.若恒压条件下,充入N,则C的物质的量减小
D.升高温度,两个反应的平衡常数都减小
NO2和N2O4可相互转化:2NO2(g)  N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是
N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是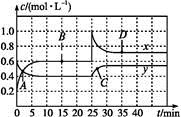
| A.图中共有两条曲线x和y,其中曲线y表示NO2浓度随时间的变化 |
| B.A、B、C、D四个点中,表示化学反应处于平衡状态的点是B和C |
| C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4 |
| D.若要达到与D相同的状态,在25 min时还可采取的措施是适当缩小容器体积 |