对于CH3COOH、HCl、H2SO4三种溶液,下列判断正确的是
| A.pH相同的三种溶液,物质的量浓度最小的是HCl |
| B.物质的量浓度相同的三种溶液,pH最小的是H2SO4 |
| C.含溶质的物质的量相同的三种溶液与过量镁粉反应,CH3COOH产生的H2最多 |
| D.相同pH、相同体积的三种溶液用NaOH溶液完全中和时,消耗NaOH溶液一样多 |
在10 ℃时某化学反应速率为0.1 mol·L-1·s-1,若温度每升高10 ℃反应速率增加到原来的2倍,为了把该反应速率提高到1.6 mol·L-1·s-1,则该反应需在什么温度下进行()
| A.30 ℃ | B.40 ℃ | C.50 ℃ | D.60 ℃ |
用纯净的CaCO3与稀HCl反应制CO2,实验过程记录如右图所示。根据分析、判断,正确的是()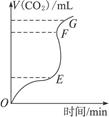
| A.OE段表示的反应速率最快 |
| B.EF段表示的反应速率最快,收集的CO2最多 |
| C.FG段收集的CO2最多 |
| D.OG段表示随着时间的推移,反应速率逐渐增快 |
下列说法正确的是()
| A.活化分子碰撞即发生化学反应 |
| B.升高温度会加快反应速率,原因是增加了活化分子的碰撞次数 |
| C.某一反应的活化分子百分数是个定值 |
| D.活化分子的碰撞不一定是有效碰撞 |
在A====B+C的反应中,温度每升高10 ℃,反应速率增大到原来的4倍,现将反应体系的温度由12 ℃升高到42 ℃,反应速率增加到原来的()
| A.8倍 | B.12倍 | C.24倍 | D.64倍 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图所示,下列表述中正确的是()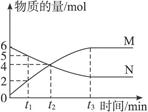
A.反应的化学方程式为2M N N |
B.t1时,正、逆反应速率相等,达平衡 |
| C.t3时,正反应速率大于逆反应速率 | D.t1时,N的浓度是M浓度的2倍 |