氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下两种实验方案。
已知:① AlN + NaOH + H2O=NaAlO2 + NH3↑
② NH3极易溶于水,难溶于四氯化碳和苯。
【方案1】用下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。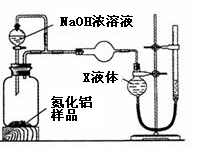
(1)为测定生成气体的体积,量气装置中的X液体可以是_______。
a.CCl4 b.H2O
c.NH4Cl溶液 d.苯
(2)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是___________。(用含m和V的代数式表达)
【方案2】按以下步骤测定样品中A1N的纯度: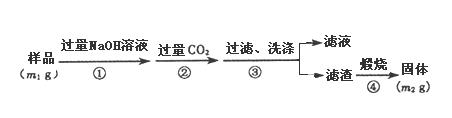
(3)步骤①的化学方程式为AlN + NaOH + H2O=NaAlO2 + NH3↑和___________________。
(4)在步骤③中洗涤沉淀的方法是_____________________________________,若未洗涤,则测定结果将________(填“偏高”、“偏低”或“无影响”)。
(5)样品中AlN的质量分数是___________。(用含m1和m2的代数式表达)
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。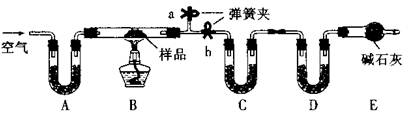
(1)实验时,B中发生反应的化学方程式为,。
(2)装置C、D中盛放的试剂分别为:
C,D(供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(3)E装置中的仪器名称是,它在该实验中的主要作用是;
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将(填“偏高”、“偏低”或“无影响”)
(5)反应前,在B装置中通入空气可减少实验误差,操作方法是。
实验题(12分)。已知在常用催化剂(如铂、钯)的催化下,氢气和炔烃加成生成烷烃,难于得到烯烃,但使用活性较低的林德拉催化剂[Pd/(PdO、CaCO3),其中钯附着于碳酸钙及少量氧化铅上],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化。现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示仪器组装而成的实验装置(铁架台未画出),拟由乙炔制得乙烯,并测定乙炔氢化的转化率。若用含0.020molCaC2的电石和1.60g含杂质18.7%的锌粒(杂质不与酸反应)分别与足量的X和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水VmL。试回答有关问题。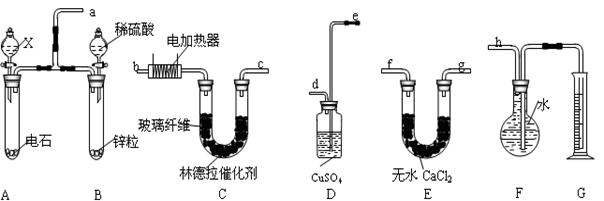 (1)所用装置的连接顺序是a、、、、、、、h(填各接口的字母)。
(1)所用装置的连接顺序是a、、、、、、、h(填各接口的字母)。
(2)写出A中所发生反应的化学方程式(有机物写结构简式):。
(3)D的作用是___________________。
(4)为减慢A中的反应速率,X应选用____________________________。
(5)F中留下的气体除含少许空气外,还有_______________________________。G所选用的量筒的容积较合理的是______________。
A.500mLB.1000mLC.2000mL
(6)若V=672mL(导管内气体体积忽略不计),则乙炔氢化的转化率为_______________。
实验目的:探究(一)同周期元素性质的递变规律
探究(二)影响化学反应速率的因素
供选试剂:锌片、锌粉、铁片、铁粉、镁条、铝条、新制Na2S溶液、新制氯水、
0.5mol/L盐酸、3mol/L盐酸等试剂(实验仪器自选)。
现有A同学设计的部分实验方案,请你帮他填写完整,并作出评价。
【实验探究一】同周期元素金属性和非金属性的递变规律
| 实验步骤 (画图表示,参照下图) |
实验现象 |
实验结论 |
|
| 非金属性递变 |
|||
| 金属性递变 |
【实验探究二】影响化学反应速率的因素
实验步骤 |
实验现象 |
实验结论 |
 (锌片和锌粉的质量相同,盐酸均过量) |
均有气体生成,锌粉比锌片消失快。 |
反应物接触面积越大,反应速率越快 |
A同学在[实验探究二]中所得结论不够严谨。原因是___________________________。
在不改变实验探究二所做实验的前提下,再补充一些实验即可完成有关探究,补充实验是(写最简方案,可不填满,也可增加):
①_________________________________;
②_________________________________;
③_________________________________。
(17分)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。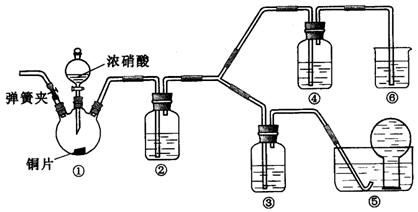
可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应。
2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是___________。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后___________。
(3)装置①中发生反应的化学方程式是___________。
(4)装置②的作用是,发生反应的化学方程式是___________。
(5)该小组得出的结论所依据的实验现象是___________。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母) ___________。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通人浓硝酸与铜反应产生的气体,观察颜色变化
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s) + H2SO4(98%)==Na2SO4 + H2O + SO2↑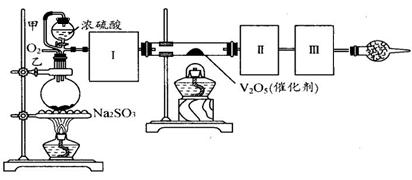
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。Ⅰ、Ⅱ、Ⅲ处连接的装置分别是__、__、__。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作顺序是。
(3)甲处导管的作用是。
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为%(用含a、b的代数式填写)
(5)尾端球形干燥管的作用是。