下列做法正确的是
| A.将新制氯水保存在无色玻璃瓶中 | B.将液氯储存在潮湿的钢瓶中 |
| C.将碘晶体保存在细口瓶中 | D.实验室将钾保存在煤油中 |
下列离子方程式书写正确的是()
| A.铜溶于浓硝酸: Cu +4HNO3 (浓) = Cu2+ + 2NO2↑+2H2O |
| B.硫酸铁溶液与氢氧化钡溶液混合:Fe3++SO42—+Ba2++3OH—=Fe(OH)3↓+BaSO4↓ |
| C.次氯酸钙溶液中通入过量的CO2: ClO—+H2O+CO2=HCO3—+HClO |
| D.碳酸氢镁与足量的石灰水反应:Mg2++2HCO3—+2OH—+Ca2+=CaCO3↓+MgCO3↓+2H2O |
右表为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中,正确的是()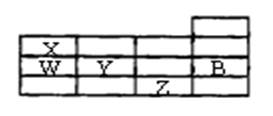
A.常压下,五种元素的单质中,Z单质的沸点最高
B.W的氢化物比X的氢化物的稳定性高
C.Y、Z的阴离子电子层结构都与B原子的相同
D.Y元素比W元素的非金属性强
下列叙述正确的是()
| A.一定温度、压强下,气体体积由其分子的大小决定 |
| B.一定温度、压强下,气体体积由其物质的量的多少决定 |
| C.气体摩尔体积是指1mol任何气体所占的体积为22.4L |
| D.不同的气体,若体积不等,则它们所含的分子数一定不等 |
下列说法中正确的是()
| A.pH小于7的雨水称为酸雨 |
| B.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| C.O3可用于游泳池的杀菌消毒 |
| D.黄铜是纯铜,青铜是合金 |
用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是
| A.相同状况下两电极上产生的气体体积之比为2 :1 |
| B.两电极上产生的气体质量之比为8 :1 |
| C.相同状况下两电极上产生的气体体积之比为4 :1 |
| D.若两电极上产生的气体质量比为16 :3,则D2O与H2O的物质的量之比为1 :1 |