下图所示装置可用于多种实验。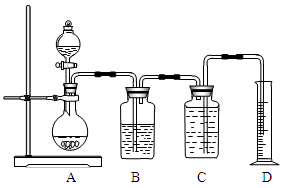
(1)实验室可利用该装置来制取氯气,发生反应的化学方程式为:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
①用双线桥标出上述反应中的电子转移情况。
②B装置的作用是___________________,C装置中盛装的液体最好是 。
③若按上述反应制得的氯气体积为4.48 L(标准状况),则实际反应中消耗12 mol/L盐酸的体积大于理论值_______mL。
(2)在实验室要测定部分变质的过氧化钠的纯度,也可用上图装置中的部分仪器。
①上述装置中多余的仪器是_______(填A、B、C、D等序号)。 ②要完成上述实验目的,圆底烧瓶中发生反应的化学方程式为____________________。
②要完成上述实验目的,圆底烧瓶中发生反应的化学方程式为____________________。
③若取用样品的质量为2.5 g,收集到气体的体积为280 mL(标准状况),则样品中Na2O2的纯度为___________。
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2·6C2H5OH。有关的有机试剂的沸点如下:CH3COOC2H5 77.1℃ C2H5OC2H5(乙醚) 34.5℃ C2H5OH 78.3℃ CH3COOH 118℃实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇与少量浓硫酸混合,然后经分液漏斗边滴加醋酸、边加热蒸馏。得到含有乙醇、乙醚、醋酸和水的乙酸乙酯粗产品。
(1)反应中加入乙醇是过量的,其目的是:。
将粗产品再经下列步骤精制:
(2)为除去其中的醋酸,可向产品中加入__________(填字母)。
A 无水乙醇 B 碳酸钠粉末 C 无水醋酸钠
(3)再向其中加入饱和氯化钙溶液,振荡。其目的是:。
(4)然后再向其中加入无水硫酸钠,振荡。其目的是:。
最后,将经过上述处理后的液体放入另一干燥的蒸馏瓶内,再蒸馏。弃去低沸点馏分,收集76~78℃沸程之间的馏分即得。
下列实验操作不正确的是 _。
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯 |
| B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇氧化为乙醛的实验 |
| C.醇中含有少量水可加入硫酸铜再蒸馏制得无水乙醇 |
| D.试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯 |
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
G.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液
(1)写出下图中序号①~④仪器的名称:
(2)仪器①~④中,使用时必须检查是否漏水的有。(填仪器序号)
(3)分离碘水中的碘应先选择装置(填装置序号)进行操作A,再选装置进行操作。进行操作A时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:(填序号)。
①常温下为液态②I2在其中溶解程度大③与水互溶程度小④密度要比水大
(4)右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 1 mol/L的稀硫酸。
可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
a.盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的
b.配制稀硫酸时,还缺少的仪器有、(写仪器名称);
c.经计算,配制480 mL 1 mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为______mL,量取硫酸时应选用mL规格的量筒;
A.10 mL B.50 mL C.100 mL D.200mL
d.对所配制的稀硫酸进行测定,发现其浓度大于1 mol/L,配制过程中下列各项操作可能引起该误差的原因有 ( )。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.定容时,俯视容量瓶刻度线进行定容
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①可选择_________或_________仪器。
(2)操作②是否可改为加硝酸钡溶液?为什么? ______________________________________
(3)进行操作②后,如何判断SO 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(4)操作③的目的是___________________,为什么不先过滤后加碳酸钠溶液?理由是___________。
(5)操作④的目的是____________________________________。
右图为探讨苯和溴的反应改进的实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上。填写下列空白:
(1) 向反应容器A中逐滴加入溴和苯的混合液,几秒钟内发生反应,写出A中所发生反应的化学方程式、;
(2) 反应开始后观察D和E两试管,看到的现象为、,说明苯和溴发生了反应(填反应类型);
(3) B中的NaOH溶液作用是吸收反应生成的溴苯中溶解的溴单质,则A中铁粉的作用是,试管C中苯的作用是;
(4) 在上述整套装置中,具有防倒吸的仪器除D外还有(填字母)。