25℃时,在等体积的①pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液、
③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×108 |
| C.1∶20∶1010∶109 | D.1∶10∶104∶109 |
在标准状况下,将NO2、NO、O2混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内HNO3的物质的量浓度的大小范围是()
A.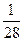 <c(HNO3)< <c(HNO3)<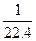 |
B.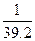 <c(HNO3)< <c(HNO3)<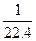 |
C.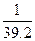 <c(HNO3)< <c(HNO3)<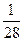 |
D.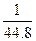 <c(HNO3)< <c(HNO3)<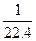 |
除去NaCl中混有的NH4Cl的最佳方法是()
| A.利用溶解度不同采用结晶法 | B.加入NaOH溶液 |
| C.直接加热 | D.加入AgNO3溶液 |
在常温常压下,将下列各组气体,等体积混合于等体积的容器中,并立即倒立于盛有水的水槽里,按试管内液面上升的高度排列正确的是()
①NH3和HCl②H2和N2③NO2和NO④NO和O2
| A.①>②>③>④ | B.①>③>④>② |
| C.①>④>③>② | D.④>③>①>② |
0.75 mol·L-1的NaOH溶液200 mL和0.5 mol·L-1的H3PO4溶液200 mL混合,生成盐的物质的量浓度接近()
| A.NaH2PO4和Na2HPO4溶液的浓度均为0.2 mol·L-1 |
| B.Na2HPO4和NaH2PO4溶液的浓度均为0.125 mol·L-1 |
| C.0.15 mol·L-1的Na2HPO4和0.10 mol·L-1的NaH2PO4 |
| D.0.1 mol·L-1的Na2HPO4和0.1 mol·L-1的Na3PO4 |
下列离子方程式不正确的是()
| A.铜与稀硝酸反应 3Cu+8 H++2 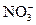 ="===3" Cu2++2NO↑+4H2O ="===3" Cu2++2NO↑+4H2O |
B.稀盐酸与氨水反应H++NH3·H2O====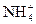 +H2O +H2O |
C.硫酸铵溶液中加入稀氢氧化钠溶液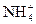 + OH-====NH3↑+H2O + OH-====NH3↑+H2O |
D.磷酸钙与过量的磷酸反应Ca3(PO4)2+4H3PO4====3Ca2++6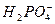 |