铋(Bi)位于元素周期表中ⅤA族,其价态为+3价较稳定,铋酸钠(NaBiO3)溶液呈无色,取一定量的硫酸锰(MnSO4)溶液依次滴加下列溶液,对应的现象如下表所示:
| 加入溶液 |
①适量铋酸钠溶液 |
②过量的双氧水 |
③适量KI淀粉溶液 |
| 实验现象 |
溶液呈紫红色 |
紫红色消失,产生气泡 |
溶液变成蓝色 |
关于NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为
A.I2、H2O2、KMnO4、NaBiO3 B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2 D.KMnO4、NaBiO3、I2、H2O2
在以稀硫酸为电解质溶液的铜——锌原电池中,已知其电极反应分别为
锌片:Zn-2e-= Zn2+;铜片:2H+ +2e-= H2↑。下列判断正确的是
| A.溶液的酸性逐渐增强 |
| B.铜片逐渐溶解 |
| C.溶液中H+向锌片作定向移动 |
| D.锌片是负极并被氧化 |
下列装置能够成原 电池的是
电池的是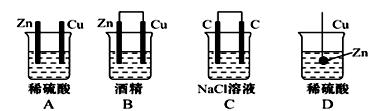
燃料电池是燃料(如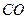 、
、 、
、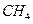 )等跟
)等跟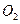 (或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如
(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如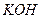 )溶液,下列关于甲烷燃料电池的说法中不正确的是:
)溶液,下列关于甲烷燃料电池的说法中不正确的是:
A.负极的电极反应式为: |
| B.通入氧气的一极发生氧化反应,通入甲烷的一极发生还原反应 |
| C.随着反应的进行,电解质溶液的pH保持不变 |
| D.甲烷燃料电池的能量利用率比甲烷燃烧的大 |
甲酸和乙酸都是弱酸,当它们的浓度为0.10mol/L时,甲酸中的 约为乙酸中
约为乙酸中 的3倍。现有两种浓度不等的甲酸溶液
的3倍。现有两种浓度不等的甲酸溶液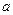 和
和 ,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为
,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为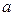 、乙酸、
、乙酸、 ,由此可知:
,由此可知:
A.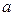 的浓度必小于乙酸的浓度 的浓度必小于乙酸的浓度 |
B.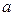 的浓度必大于乙酸的浓度 的浓度必大于乙酸的浓度 |
C.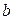 的浓度必小于乙酸的浓度 的浓度必小于乙酸的浓度 |
D.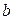 的浓度必大于乙酸的浓度 的浓度必大于乙酸的浓度 |
某温度下,在一容积可变的容器中,反应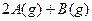

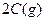 达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是:
达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是:
A、均减半 B、均加倍
C、均增加1mol D、均减小1mol