[化学——选修5:有机化学基础](15分)
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下: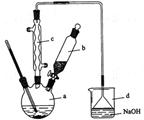
| |
苯 |
溴 |
溴苯 |
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |
按以下合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL 液溴。向a中滴入几滴液溴,有白雾产生,写出产生白雾的化学方程式 。继续滴加至液溴滴完。装置d中NaOH溶液的作用是 。
(2)反应过程中,a外壁温度升高,为提高原料利用率,需利用温度计控制温度,适宜的温度范围为(填序号) 。
A.>156℃ B.59℃-80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。
此操作所需要的玻璃仪器除烧杯外,还需 ,用NaOH溶液洗涤的作用是 ;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是 。
(4)经过上述分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(14分)二氯化二硫(S2C12)在工业上常用作橡胶硫化剂。实验室可用如下装置(略去夹持仪器)模拟生成过程。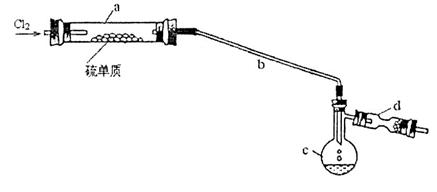
查阅资料:
①S2Cl2是一种金黄色易挥发液体(熔点:-76℃,沸点:138℃),具有强烈的窒息性,且易与水发生水解反应。
②将干燥的氯气在110℃~140℃与硫反应,即得到S2C12粗品。
(1)装置I、II、II连接可制取纯净、干燥的氯气,则两个II装置内的试剂依次是__________________。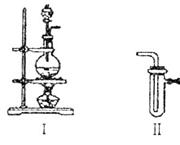
制备C12的过程中,某实验小组利用刚吸收过少量SO2的NaOH溶液吸收C12,防止污染环境。吸收一段时间后,某同学取出2mL吸收后的溶液(强碱性)于试管中,充分振荡后向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,随即又褪去。溶液先变蓝,说明吸收Cl2后的溶液中存在__________(填微粒符号),蓝色褪去的可能原因是_____________________(用离子方程式回答)。
(2)长玻璃管b的作用是___________________。
(3)该实验的操作顺序应为______________________________ (用序号表示)。
| A.加热装置a | B.通入C12 |
| C.停止通Cl2 | D.停止加热装置a |
(4)装置d中应放置的试剂为______________________,其作用为__________________。
(4分)化学是一门以实验为基础的科学。
(1)下列与实验相关的叙述正确的是______________________(填写代号)。
A.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
B.“中和滴定”实验中,左手控制滴定管的玻璃活塞,右手旋摇锥形瓶,两眼注视滴定管内溶液液面变化,直至滴定终点
C.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
D.已知I3-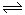 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CC14中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CC14中的溶解度比在水中的大
E.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用
(2)用仪器A、B和胶管组成装置收集NO气体(注:仪器A气密性良好;除水外不能选用其它试剂),正确的操作步骤是_________________________。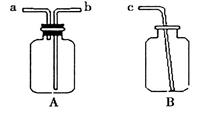
(13分)实验室为探究铁与浓硫酸的反应,并验证SO2的性质,设计如图所示装置进行实验。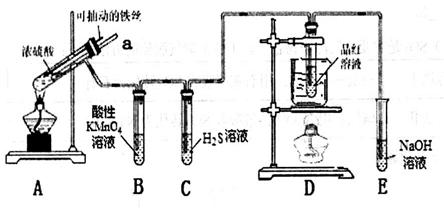
请回答下列问题:
(1)实验时A中导管a插入浓硫酸中,可使B中的溶液不发生倒吸。其原因是_______。
(2)B中酸性KMnO4逐渐褪色,则B中反应的离子方程式是_______________________;C中反应的化学方程式是_________________。
(3)D装置的作用是________;实验结束时需从a导管通入大量空气,其目的是___________。
(4)欲探究A装置中反应后铁元素的价态,设计实验方案如下:将反应后试管中的溶液稀释。取少许溶液,滴入3~5滴________溶液,若溶液呈红色,则证明含有Fe3+,否则不含Fe3+;取少许溶液,滴入3~5滴________溶液,若溶液褪色,则证明含有Fe2+,否则不含Fe2+。若实验证明反应后的溶液中只含有Fe3+,则A中反应的化学方程式是___________________________________________。
浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下: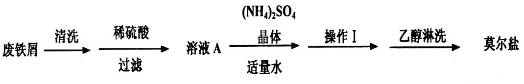
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是_________;
证明溶液A不含Fe3+离子的最佳试剂是_______________(填序号字母)。
a.酚酞溶液 b.KSCN溶液 c.烧碱溶液d.KMnO4溶液
操作I的步骤是:加热蒸发、___________、过滤。
(2)浓度均为0.1mol·L-1莫尔盐溶液和(NH4)2SO4溶液,c(NH4+)前者大于后者,原因是______。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平_______(填“左”“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a 接__________;__________接__________。
(5)将装置C中两种液体分离开的操作名称是_________。装置D的作用是_______________。
实验室制取乙烯的装置如下图所示,请根据图示回答下列问题: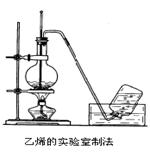
(1)实验室制乙烯的化学方程式为____________________________________
在这个反应中,浓硫酸的作用是____和_____。
(2)某化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
①I、II、Ⅲ、IV装置可盛放的试剂是IIIⅢIV____(填试剂的序号)。
| A.品红溶液 | B.NaOH溶液 |
| C.浓硫酸 | D.酸性KMnO4溶液 |
②能说明SO2气体存在的现象是_____________________________________________。
③确定含有乙烯的现象是____________________________________________________ 。