在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛。
(1)溴元素在周期表中的位置为 。
(2)下列说法中正确的是 。
| A.CCl4和XeF2分子中各原子最外层均满足8e-结构 |
| B.Cl2O5和Cl2O7都是酸性氧化物 |
| C.氟非金属性强于氯,故氢氟酸的酸性强于盐酸 |
| D.F-、Cl-、Br-、I-等离子的还原性逐渐增强 |
(3)已知:HCl的沸点是﹣85.0℃,HF的沸点是19.5℃。HF的电子式为 ;从HF、HCl混合气体中分离出HF的方法是 。
(4)向NaClO浓溶液中加入Al2(SO4)3浓溶液,迅速生成大量白色沉淀,同时有无色气体产生。生成 白色沉淀的离子方程式为 。无色气体的成分为 。
(5)潮湿的氯气与碳酸钠粉末反应可用于制取氯的最低价氧化物,反应还同时生成两种盐,该反应的 化学方程式为 。
(6)已知:还原性HSO3¯>I¯,氧化性IO3¯> I2,在下图中画出向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液的过程中,析出I2的物质的量与KIO3的物质的量之间关系的曲线。

有下列各组物质:
| A.O2和O3; |
| B.126C和136C; |
| C.CH3-CH2-CH2-CH3和CH3-CH(CH3)CH3; |
| D.冰醋酸和乙酸; |
E.甲烷和庚烷;
F.淀粉和纤维素。
(1)组两物质互为同位素。
(2)组两物质互为同素异形体。
(3)组两物质属于同系物。
(4)组两物质互为同分异构体。
(5)组是同一物质。
元素周期表是学习化学的重要工具,它隐含许多信息和规律。下列元素:氧、镁、铝、硫、氯。
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分)。
(2)铝元素处于周期表中的位置是;
(3)比较这五种元素的原子半径从大到小:(填元素符号)
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是(填化学式);
(5)用电子式表示镁、氯形成化合物的过程;
电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.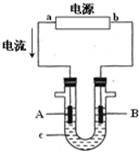
(1)若A、B都是惰性电极,c是饱和NaCl溶液,实验开始时,同时向U型管两边各滴入几滴酚酞试液,试判断
①a是极(填“正”或“负”);
②写出该池中总反应的离子方程式.
③A电极上的电极反应式为,该反应属于(填“氧化反应”或“还原反应”)
④B极区附近观察到的现象是.
(2)如要用电解方法精炼粗铜,电解液c选用CuSO4溶液,则B电极的材料是,电极反应式为.
(3)用惰性电极电解CuSO4溶液.若阴极上析出Cu的质量为3.2g,则阳极上产生的气体在标准状况下的体积为;
请写出298 K 101 kPa时,下列反应的热化学方程式
(1)1 mol C与1 mol水蒸气反应生成1 mol CO和1 mol H2,吸热131.5 kJ:________。
(2)用CO(g)还原1 mol Fe2O3(s),放热24.8 kJ:__________________________________。
下表是周期表中的一部分,根据A-I在周期表中的位置,按题目要求回答。
| 族 周期 |
I A |
Ⅱ A |
Ⅲ A |
Ⅳ A |
Ⅴ A |
Ⅵ A |
Ⅶ A |
O族 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)表中元素,化学性质最不活泼的是,氧化性最强的单质是(以上填化学式)
(2)最高价氧化物的水化物酸性最强的是(填化学式)。
(3)A分别与D、E形成的化合物中,最稳定的(填化学式)。
(4)在B、C、E、F、G、H中,原子半径最大的是(填元素符号)
(5)A和D组成化合物的电子式,A、E、H三元素组成的化合物EA4H中所含的化学键为______________________。
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式 _____________。