对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是
| A.加入适量的氯化铵晶体后,两溶液的pH均减小 |
| B.温度下降10℃,两溶液的pH均不变 |
| C.分别加水稀释10倍,两溶液的pH仍相等 |
| D.用同浓度的盐酸中和,消耗的盐酸体积相同 |
在原电池和电解池的电极上所发生的反应,属于还原反应的是()
| A.原电池的正极和电解池的阳极所发生的反应 |
| B.原电池的负极和电解池的阳极所发生的反应 |
| C.原电池的正极和电解池的阴极所发生的反应 |
| D.原电池的负极和电解池的阴极所发生的反应 |
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是()
| A.1/2N2H4(g)+O2(g)====1/2N2(g)+1/2H2O(g);ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH =-534 kJ·mol-1 |
| C.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH =+534 kJ·mol-1 |
| D.N2H4(g)+O2(g)====N2(g)+2H2O(l);ΔH =-133.5 kJ·mol-1 |
下列各图所表示的反应是吸热反应的是()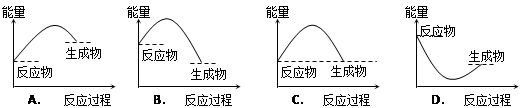
下列说法中不正确的是()
| A.反应热指的是反应过程中吸收或放出的能量 |
| B.热化学方程式的化学计量数可表示分子的个数 |
| C.在热化学方程式中无论反应物还是生成物均必须标明聚集状态 |
| D.所有的化学反应均伴随能量变化 |
下列操作中,完全正确的一组是()
①用试管夹夹持试管时,试管夹从试管底部上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶的液体时,取下瓶塞倒立放在桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体
⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热。
| A.①④⑦⑩ | B.①④⑤⑦⑩ | C.①④⑤⑦⑧⑩ | D.④⑤⑦⑧⑩ |