下列说法正确的是
A.常温下0.4 mol/L HB溶液 和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B—)>c(H+)>c(Na+)>c(OH—)
B.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等
C.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3·H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
D.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是()
①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H =" +" 49. 0 kJ·mol-1
②CH3OH(g)+1/2O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1
下列说法正确的是 ( )
| A.1mol CH3OH充分燃烧放热为192. 9 kJ |
| B.反应①中的能量变化如上图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l) +1/2O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1 |
有甲、乙、丙、丁四种金属,将甲、乙用导线相连放人稀硫酸中可以看到乙慢慢溶解,而甲的表面有气泡逸出;把丁放到乙的硝酸盐溶液中后,丁表面覆盖一层乙的单质;用石墨电极电解含有相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出;将甲放入稀盐酸中有H2析出,已知四种金属中有一种是铜,根据以上实验判断铜是()
A 甲 B乙 C丙 D丁
下面有关晶体的叙述中,正确的是()
| A.分子晶体中一定存在共价键 |
| B.第ⅦA族氢化物随相对分子质量增加,熔沸点逐渐升高,HF沸点最低 |
| C.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏 |
| D.熔融状态下导电的晶体一定是金属晶体 |
下列实验操作与实验目的相符的是()
| 序号 |
实验操作 |
实验目的 |
| A |
测定HF、HCl的熔点、沸点 |
比较F、Cl的非金属性强弱 |
| B |
MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 |
比较镁、铝的金属性强弱 |
| C |
将SO2气体通入碳酸钠溶液中 |
比较碳、硫的非金属性强弱 |
| D |
将钠、镁、铝投入等浓度盐酸中 |
比较Na、Mg、Al的金属性强弱 |
下图是可逆反应X2(g)+ 3Y2(g) 4Z2(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是()
4Z2(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是()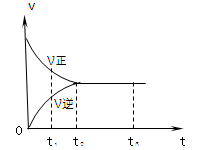
| A.t1时,只有正方向反应 | B.t2时,V正>V逆 |
| C.t2- t3,反应不再发生 | D.t2- t3,各物质的浓度不再发生变化 |