X、Y、Z、W四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
空气含量最多的元素 |
| Y |
3p能级只有一个电子 |
| Z |
单质用于制造集成电路和太阳能板的主要原料 |
| W |
常见化合价有+2、+3,其中一种氧化物为红褐色 |
(1)W位于周期表的第 周期,第 族。
(2)用“>”或“<”填空。
| 离子半径 |
电负性 |
第一电离能 |
单质熔点 |
| X Y Z |
Z W |
X Z |
X W |
(3)X2、碳和Z的氧化物在1300℃时可合成Z3X4。写出该反应化学方程式 。Z3X4是一种耐高温的结构陶瓷材料,是 化合物(填“共价”或“离子”)。
(4)查阅资料知道:
4Y(s)+3O2(g)=2Y2O3(s) △H=-3351.4 kJ.mol-1
3W(s)+2O2(g)=W3O4(s) △H=-1120 kJ.mol-1
则Y与W3O4反应的热化学方程式是: 。
X、Y、Z三种物质有如图所示转化关系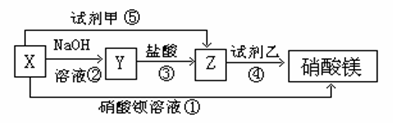
(1)根据上述转化关系,写出下列物质的化学式:X、Y、
Z试剂甲,试剂乙(每空1分)。
(2)写出上述各步反应①~⑤的离子方程式:
①;②;
③;④ ;
⑤(每空2分)。
现有四瓶溶液,分别是H2SO4、BaCl2、Na2SO4、Na2CO3中的一种,根据以下实验,请分别确认A、B、C、D各是什么物质?
A加入B中无反应。A加入C中有气体产生,D加入A中有沉淀产生。
则:A:________; B:________;C:_________;D:___________(每空1分)。
写出A与C反应的离子方程式
A与D反应的离子方程式。_______________(每空2分)。
已知铜在常温下能被稀HNO3溶解:3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O
⑴请将上述反应改写成离子方程式:_________________________________
⑵上述反应中氧化剂是______,氧化产物是______,在反应的硝酸中,没有参加氧化还原反应的硝酸占总硝酸的______
用双线桥标出以下方程式中元素化合价变化、电子转移及数目并指出氧化剂还原剂。
(1)4Al + 3O2 ="=" 2Al2O3(2)2H2O2 ="==" 2H2O + O2↑
氯化钠样品含有少量的Na2SO4 和 Na2CO3,按下列流程进行净化,请在流程中的()中写上合适的试剂,在[ ]中写上实验操作名称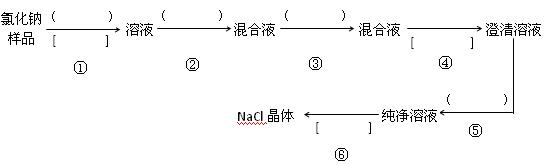
写出有关反应的化学方程式:
第②步
第③步
第⑤步