【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为 。
(3)与CN-互为等电子体的一种分子为 (填化学式);1mol Fe(CN)63-中含有σ键的数目为 。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于 (填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。
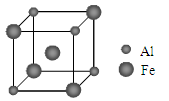
该合金的化学式为 。
B.[实验化学]
工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸)。
【反应原理】
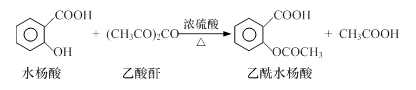
【物质性质】
| 试剂 |
沸点(℃) |
溶解度 |
化学性质 |
||||
| 水杨酸 |
211 |
微溶于冷水,易溶于热水 |
|
||||
| 乙酸酐 |
139 |
在水中逐渐分解 |
|
||||
| 乙酰水杨酸 |
|
微溶于水 |
与碳酸钠反应生成水溶性盐 |
【实验流程】
(1)物质制备:向125 mL的锥形瓶中依次加入4 g水杨酸、10 mL乙酸酐(密度为1.08g/mL)、0.5 mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10 min。
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是 。
②控制反应温度85℃~90℃的原因 。
(2)产品结晶:取出锥形瓶,加入50 mL蒸馏水冷却。待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干。简要叙述如何洗涤布氏漏斗中的晶体? 。
(3)产品提纯:将粗产品转移至150 mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止。进一步提纯最终获得乙酰水杨酸3.6 g。
①试剂X为 。
②实验中乙酰水杨酸的产率为 (已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180)。
(4)纯度检验:取少许产品加入盛有5 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是 。
(12分)(1)有A、B、C、D四种烃,在常温下A、C是气体,B、D是液体。A完全燃烧后生成二氧化碳与水物质的量之比是2:1;B的分子量是A的三倍;C既不能使酸性高锰酸钾溶液褪色也不能使溴水褪色,但在光照条件下最多可与六倍体积氯气发生反应;燃烧相同物质的量C与D,生成二氧化碳的体积比为1:4,D不能使溴水褪色但能使酸性高锰酸钾溶液褪色,在催化剂作用下1摩尔D能与3摩尔氢气完全反应;在铁粉存在下与溴反应生成一溴代物只有一种。试推断有机物A、B、C、D,分别写出结构简式:
A:______________ B:_____________
C:______________ D:___________
(2)相对分子质量为72的某烃,其分子式是___________,若此有机物的一氯代物分子中有两个-CH3、两个-CH2-、一个 和一个-Cl,它可能的结构有__________种.(本题不考虑对映异构体)
和一个-Cl,它可能的结构有__________种.(本题不考虑对映异构体)
下图是由4个碳原子结合成的6种有机物(氢原子没有画出)
(1)写出有机物(a)的系统命名法的名称 _________
(2)有机物(a)有一种同分异构体,试写出其结构简式 __________
(3)上述有机物中与(c)互为同分异构体的是(填代号)
(4)任写一种与(e)互为同系物的有机物的结构简式 ______
(5)上述有机物中不能与溴水反应使其退色的有(填代号)
写出下列反应的化学方程式,并指出该反应属于何种反应类型
(1)丙烯通入溴水使溴水退色
(2) 苯和溴单质在铁粉作催化剂条件下反应
(3)工业上由乙炔制聚氯乙烯
________________________
(1)下列有机化合物都有各种官能团,请回答 
可看作醇类的是 可看作酚类的是
可看作羧酸类的是 可看作醛类的是___________________
( 12分)A、B、C、D四种元素,A单质在B单质中燃烧发出苍白色火焰,C单质跟A、B形成的化合物的水溶液反应生成A单质,C原子与B原子的电子层数相同,且最外层电子数之差为奇数,D原子最外层电子数为K层电子数的3倍,其单质为淡黄色固体。
(1)四种元素符号为:A____________,B____________,C____________,D____________;
(2)离子的电子层结构相同的两种元素是______与_____,离子的结构示意图分别为____________、________________;
(3)A、B、C、D原子形成的最高价氧化物的化学式分别为__________、__________、__________、__________。