N2(g)+3H2(g)≒2NH3(g) △H=-92.2KJ/mol。在2L恒容密闭容器中各物质的浓度随时间变化的曲线如图所示。下列说法错误的是
| A.若时段I中投入物质的浓度为原来的2倍,则反应物的转化率增大,平衡常数不变 |
| B.第25min改变的条件是将NH3从反应体系中分离出去 |
| C.若第60min时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
| D.前25min内反应放出的热量为46.lkJ |
欧洲核子研究中心于1995年9月10日研制成世界上第一批反原子——共9个反氢原子,揭开了人类制取、利用反物质的新篇章。请完成下列问题:
(1)反氢原子的结构示意图中,正确的是( )
(2)如果制取了反氧原子,则下列说法中,正确的是( )
A.核内有8个带正电的质子,核外有8个带负电的电子
B.核内有8个带负电的电子,核外有8个带正电的质子
C.核内有8个带负电的中子,核外有8个带正电的质子
D.核内有8个带负电的质子,核外有8个带正电的电子
(3)以下表示反物质酸碱中和反应的通式是( )
A.H++OH+ H2O B.H++OH+
H2O B.H++OH+ H2O
H2O
C.H-+OH- H2O D.H++OH-
H2O D.H++OH- H2O
H2O
有几种元素的粒子的结构示意图如下图所示,其中:
(1)某中性粒子一般不和其他元素的原子发生反应,这种粒子的符号______。
(2)某粒子的盐溶液,加入AgNO3溶液时会出现白色沉淀,这种粒子的符号是______。
(3)某粒子氧化性很弱,但得到1个电子后还原性很强,这种粒子的符号是______。
(4)某粒子具有很强的还原性,且这种粒子失去了2个电子即变为原子,这种粒子的符号是______。
某金属元素的一种同位素R的质量数为52,已知R离子含28个中子,21个电子,由这种离子组成的化合物的化学式正确的是( )
| A.RCl2 | B.R(OH)3 | C.RO2 | D.K2R2O7 |
已知元素R的某种同位素的氯化物RClx为离子化合物,R离子核内中子数为y个,核外电子数为z个,则该同位素的符号应表示为( )
A.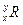 |
B.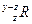 |
C.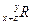 |
D.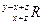 |
某元素同位素的单质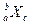 ,极易形成
,极易形成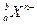 ,下列说法不正确的是( )
,下列说法不正确的是( )
| A.此气体分子中含有的中子数为b-a |
| B.此元素的离子中含有的电子数为a+n |
| C.此气体分子中含有的质子数为c(a+n) |
D.一个该同位素原子的质量约为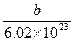 g g |