向100mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是
| A.c点溶液呈碱性 |
| B.b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH—=Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200 mL |
| D.a点的溶液呈中性 |
下列说法正确的是( )
| A.冰醋酸中醋酸分子之间存在氢键,不存在范德华力 |
| B.含氢键的物质的熔点一定高于不含氢键的物质 |
| C.碘升华时,分子内共价键不发生变化 |
| D.水结冰体积膨胀与氢键无关 |
化学在生产和日常生活中有着重要的应用。下列说法不正确的是()
| A.明矾水解生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B.高温电解Al2O3可制得金属铝 |
| C.MgO的熔点很高,可用于制作耐高温材料 |
| D.根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应 |
下列叙述中,正确的是( )
| A.在基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B.在基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C.在基态多电子的原子中,M层的电子能量肯定比L层上的电子能量高 |
| D.如果某一基态原子3p能级上仅有2个电子,它们自旋方向必然相反 |
NA为阿伏伽德罗常数,下列叙述错误的是()
| A.18gH2O中含有的质子数为10NA |
| B.12g金刚石中含有的共价键数为4 NA |
| C.46gNO2和N2O4混合气体中含有的原子总数为3 NA |
| D.1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
以乙醇为原料,用下述6种类型的反应①氧化 ②消去 ③加成 ④酯化 ⑤水解 ⑥加聚,来合成乙二酸乙二酯(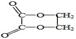 )的正确顺序是( )
)的正确顺序是( )
| A.①⑤②③④ | B.①②③④⑤ |
| C.②③⑤①④ | D.②③⑤①⑥ |