(1)氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为 ,其沸点比氨气 (填“高”或“低”),该氢化物与足量盐酸反应的化学反应方程式为 。
(2)类似于碳原子,氮原子间也可形成链状结构。某链状结构氮氢化合物中,氮原子间只以N-N单键形式连接形成氢化物。该系列氮氢化合物化学通式为 (n表示氮原子个数)。
(3)生活中广泛使用烃类物质(CmHn)燃料,火箭发射时的高能燃料常用氮氢化合物,比如肼N2H4。2014年10月31日在测试飞行时坠毁的维珍银河公司“太空船2号”商业载人飞船用N2H4燃料,但助燃剂选择不当据说是事故原因之一。经分析该助燃剂分子由氮、氧原子组成,分子中原子最外层电子总数和CO2分子中原子最外层电子总数相同。该助燃剂的化学式为 。上述燃烧反应产物绿色、环保,书写该燃烧反应的化学方程式为 。
(4)分子式为N4的氮元素同素异形体,结构等同于白磷,N4中每个原子满足最外层8e-结构。则1molN4中含有 对共用电子对。已知NH3、-NH2、 、
、 一定条件下都可以和H+结合。则N4和足量的H+反应生成的粒子的化学式为 。化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为 。
一定条件下都可以和H+结合。则N4和足量的H+反应生成的粒子的化学式为 。化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为 。
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度 /mol.L-1 |
4×10-5 |
6×10-5 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性,试样的pH=_________。
Ⅱ.NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①N2(g)+O2(g) 2NO(g)△H=________。
2NO(g)△H=________。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式___。
2CO(g)═2C(s)+O2(g),已知该反应的△H>0,该设想不能实现,他的依据是_______。
Ⅲ.碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应___________________________。
②用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M  NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示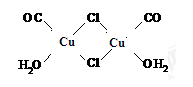
工业上制备该物质的反应如下:2CuCl+2CO+2H2O=Cu2Cl2·2CO·2H2O
(1)该配合物中金属阳离子的核外电子排布式为______________________;
(2)与CO为互为等电子体的阴离子是_______________(写一种即可)。
第二周期元素中,第一电离能介于B、N之间的元素除C外,还有_______(填元素符号)。
(3)该配合物中,氯离子的杂化方式为__________;用“ ”标出该物质中配位键。
”标出该物质中配位键。
(4)CuCl的晶胞如右图所示,距离每个Cu+最近的Cl-的个数为_______。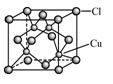
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:
N2(g)+2H2(g)=N2H4(l)△H=+50.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=______________kJ•mol-1
②用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是___________________。
(2)污水中的NH4+可以用氧化镁处理,发生如下反应:
MgO+H2O Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+ Mg2++2NH3•H2O
Mg2++2NH3•H2O
①温度对氮处理率的影响如图所示.在25℃前,升高温度氮去除率增大的原因是___________________。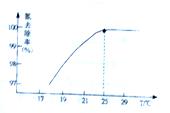
②剩余的氧化镁,不会对废水形成二次污染,理由是___________________。
(3)污水中的含氮化合物,通常先用生物脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H++H2O;2HNO2+O2=2HNO3),然后加入甲醇,NO3-和甲醇转化为两种无毒气体。
①上述方法中,14g铵态氮元素转化为硝态氮元素时需氧的质量为_____________g。
②请写出加入甲醇后反应的离子方程式___________________。
(4)甲醇燃料电池的工作原理如下图所示,则该电池负极的电极反应式为_________。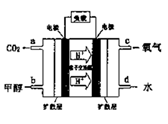
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是_________________,所得滤渣的主要成分是_________(写化学式)。
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式_________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]•3H2O.
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是______________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式______________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是______________。
(5)溶解:CoCl2的溶解度曲线如图所示向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是______________。
(6)灼烧:准确称取所得CoC2O4 1.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式_________。
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等。已知①亚氯酸钠(NaClO2)受热易分解。
②NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
③纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)“反应1”需要鼓入空气,空气的作用是_______________
(2)“反应2”的化学方程式为:_______________
(3)采取“减压蒸发”而不用“常压蒸发”,原因是_______________;结晶后需要对晶体洗涤,为了减少损失,可以用_______洗澡晶体。
(4)从“母液”中可回收的主要物质是___________;
(5)要得到纯的亚氯酸钠晶体(NaClO2·3H2O),对粗产品的必须进行的操作名称__________。