一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350 mL 2 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
| A.0.21 mol | B.0.25 mol | C.0.3 mol | D.0.35 mol |
T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为: ,有关该平衡体系的说法正确的是()
,有关该平衡体系的说法正确的是()
| A.升高温度,平衡常数K增大 |
B.升高温度,若混合气体的平 均相对分子质量变小,则正反应是放热反应 均相对分子质量变小,则正反应是放热反应 |
| C.增大压强,W(g)体积分数增加 |
| D.增大X(g)浓度,平衡向正反应方向移动 |
.下列实验能达到预期目的的是()
| 编号 |
实验内容 |
实验目的 |
| A |
将SO2通入溴水,溴水褪色后加热观察能否恢复原色 |
验证SO2漂白的可逆性 |
| B |
将氯水加入淀粉KI溶液中 |
验证Cl的非金属性比I强 |
| C |
把铁块和铜块用导线连接插入浓硝酸中 |
组成原电池验证Fe比Cu活泼 |
| D |
加热氯化铵和碘单质的固体混合物 |
分离除去碘单质 |
一定条件下,体积为2L的密闭容器中,1mol A和1mo1 B进行反应:
A(g)+3B(g) 2C(g)经2分钟反应达到平衡,此时生成0.2mol C。
2C(g)经2分钟反应达到平衡,此时生成0.2mol C。
下列说法正确的是()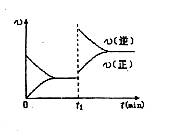
A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L.min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
D.若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图
室温下,下列叙述正确的是(溶液体积变化忽略不计)()
| ① |
② |
③ |
④ |
|
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| pH |
11 |
11 |
3 |
3 |
A.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
B.在①、②中分别加入氯化铵固体,两溶液的pH均增大
C.①、④两溶液等体积混合,所得溶液中c(C1-)> c (NH )> c (OH一)> c (H+)
)> c (OH一)> c (H+)
D.②、③两溶液混合,若所得溶液的pH=7,则c (CH3COO一)> c (Na+)
用铂作电极电解500 mL含KNO3和Cu(NO3)2的混合溶液一段时间后,在两极均生成11.2L标准状况下的气体,原溶液中Cu2+的物质的量浓度为()
| A.0.5 mol/L | B.2 mol/L | C.l mol/L | D.无法确定 |