NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为________________。
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为_________________。
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
①NaOH标准溶液应盛放在下图所示的滴定管____(选填“甲”或“乙”) 中。
②滴定时所用的指示剂X可为________,判断滴定终点的方法是_________________________。
③下列操作会导致测定结果偏低的是________________
| A.碱式滴定管未润洗 |
| B.锥形瓶用待测液润洗 |
| C.读取标准液读数时,滴定前仰视,滴定到终点后俯视 |
| D.滴定前碱式滴定管尖嘴处有气泡未排除,滴定后气泡消失 |
④滴定实验记录如下表(样品中杂质不与酸或碱反应)。
| 滴定次数 |
待测溶液A的体积(mL) |
消耗0.1000mol·L-1NaOH溶液的体积 |
| 1 |
25.00 |
22.50 |
| 2 |
25.00 |
22.55 |
| 3 |
25.00 |
22.45 |
试计算样品中Na5P3O10的物质的量为__________mol。
把CO2通入浓的NaOH溶液中,反应开始时反应的离子方程式为;若继续通入CO2直至过量,则有细小晶体析出,其反应的化学方程式为;
然后将析出晶体后的溶液分成2等份,分别滴入少量下列溶液,反应的离子方程式为:
⑴NaOH溶液:;
⑵HCl溶液:。
由若干种可溶性物质组成的固体混合物X,可能含有的阳离子和阴离子分别是: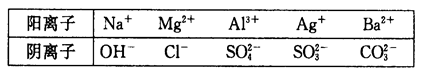
为了鉴定其中的离子,现进行如下实验,试根据实验现象和要求填空。
(1)取少许该白色固体加水溶解,最后得到无色溶液;用pH试纸检测,溶液的pH为13。则X中一定不存在的离子是_____________。
(2)向溶液中滴加盐酸溶液,刚开始无沉淀,后有沉淀生成,继续滴加沉淀消失,并有无色无味气体逸出。则X中一定存在的离子是____________;又可确定X中一定不存在的离子有________________.
(3)若组成X的物质有三种,则可能是(用化学式表示,写出一组即可)____________。
(4)尚待检验的离子及检验方法是:
| 尚待检验的离子 |
检验方法 |
中学化学中几种常见物质的转化关系如下: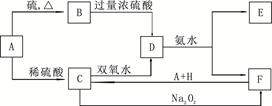
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体粒子直径大小的范围:
(2)B的化学式: ,
(3)①写出C的溶液(A→C稀硫酸过量)与双氧水反应的离子方程式:
②写出B与少量稀硝酸反应的离子反应方程式:
③写出A的三价氯化物水溶液与NaHCO3溶液混合后反应的离子方程式:
(4)写出鉴定E中阳离子的实验方法和现象:
近年来,我国储氢钠米碳管研究获重大进展,电弧法合成的碳纳米管常伴有大量物质――碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7+ H2SO4(稀) → CO2↑+ K2SO4+ Cr2(SO4)3+
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是_______________,氧化产物是________________。
(3)H2SO4在上述反应中表现出来的性质是_________(填选项编号)。
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生11g气体物质,则转移电子的数目为_________。
下图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。
(1)若烧瓶中盛装锌片,分液漏斗中盛装稀硫酸,则: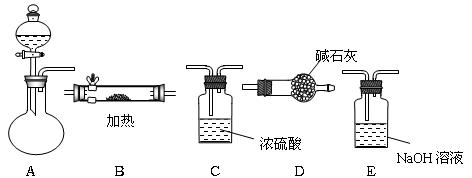
① 当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是CuO、无水CuSO4粉末。其作用分别是
② D装置的作用是。
③ 加热前必须进行的操作是。
(2)若烧瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,则: ①烧瓶内产生的气体主要有(写化学式)。
②用产生的气体经干燥后做氨的催化氧化实验,B内放置铂铑合金网,各仪器装置按气流方向从左到右连接顺序是(填字母)(A )→(D )→(B )→( D);装置B中可能观察到的现象是,该现象证明NH3具有性。