(1)近年来我国京、津、冀等多地出现雾霾天气,主要原因是空气污染严重所致,下列有关治理空气污染的方法正确的是___________。
A.大力开发核能、氢能、风能、海洋能和生物质能等能源
B.限制使用电动车
C.我国煤炭储量丰富,可以大力发展火力发电
D.节日可尽情燃放烟花爆竹
(2)食品中加入营养强化剂是为了补充食品中缺乏的营养成分或微量元素。下列说法中不正确的是____。
A.人体缺碘,可通过食用加碘盐补碘
B.亚硝酸盐可常用作腌制肉类食品的防腐剂,大量进食易致癌
C.维生素或钙、硒等不能添加在食品中
D.缺铁性贫血,可通过食用铁强化酱油预防
(3)下列关于药物使用的说法中,正确的是___________。
A.长期大量服用阿司匹林可预防疾病,没有毒副作用
B.随着平价药房的开设,病人都可以到药店自行买药服用,不用到医院就诊
C.使用青霉素可直接静脉注射,不需要进行皮肤敏感试验
D.碘酒能使蛋白质变性,医院里常用于皮肤消毒
(4)在我国一些大城市,汽车等机动车排出的一些大气污染物主要有CO、 、 和碳氢化合物等。治理汽车尾气中NO和CO 的一种方法是:在汽车的排气管上装一个催化转化装置,使NO和CO反应,生成CO2和N2,反应的化学方程式是 。
(10分) 1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+、K+、Mg2+、Al3+、NH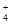 、Fe2+、Fe3+ 、Fe2+、Fe3+ |
| 可能大量含有的阴离子 |
Cl-、Br-、I-、CO32-、AlO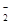 |
⑴往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)
与加入NaOH溶液的体积(V)的关系如右图所示。
则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为。
(3)V1、V2、 V3、 V4之间的关系。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的
Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,
分析后回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
| n(Cl-) |
1.25mol |
1.5mol |
2mol |
| n(Br-) |
1.5mol |
1.4mol |
0.9mol |
| n(I-) |
a mol |
0 |
0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
⑴肼的结构式为:。
⑵如图是一个电化学过程示意图。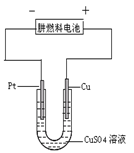
①铂片上发生的电极反应是。
②假设使用肼一空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气L(假设空气中氧气体积含量为20%)。
⑶肼——空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是20%—30%的 KOH溶液。肼——空气燃料电池放电时:负极的电极反应式是。
现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
原子的电子排布图为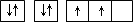 |
| B |
常温下单质为双原子分子,原子间形成三对共用电子对 |
| C |
原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
| D |
二价阳离子与C的阴离子具有相同的电子层结构 |
| E |
原子序数是D两倍, |
根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的电负性由小到大的顺序为;
(2)B的氢化物的分子空间构型是,该氢化物的等电子体是;
(3)E的价电子排布式是,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为;
(4)AC2在高温高压下所形成的晶胞如图所示。该晶体的类型属于(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为;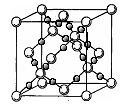
(5)D 的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:。
、硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~900℃时,硫铁矿在纯净的氧气中煅烧,可能发生下列反应:
① 3FeS2+8O2→Fe3O4+6SO2② 4FeS2+11O2→2Fe2O3+8SO2
⑴为使FeS2煅烧完全生成Fe2O3,使用过量氧气,当氧气过量20%时,求所得炉气中SO2的体积分数。(写出计算过程)
⑵480 g纯净的FeS2在氧气中完全反应,若所得固体中,Fe和O的物质的量之比
n(Fe)∶n(O)=4∶a,此时消耗氧气b mol。
①试写出b与a的关系式:_____________。
② b的最大值为____,最小值为___________。
、联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
⑴沉淀池中发生反应的化学方程式为_____________________;
⑵X是______,Y是______(填化学式);
⑶从理论上分析,在氨碱法生产过程中_______(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 ;
⑷根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是____;
a.常温时氯化铵的溶解度比氯化钠小 b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
⑸相比于氨碱法,指出联碱法的一项优点______________。