电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。下列叙述中正确的是
| A.A膜是阳离子交换膜 |
| B.通电后,海水中阴离子往b电极处运动 |
| C.通电后,b电极上产生无色气体,溶液中出现白色沉淀 |
| D.通电后,a电极的电极反应式为:4OH--4e- = O2↑+2H2O |
将1 mL 0.1 mol·L-1的H2SO4溶液加入纯水中制成200 mL溶液,该溶液中由水自身电离产生的c(H+)最接近于()
| A.1×10-3 mol·L-1 | B.1×10-11 mol·L-1 |
| C.1×10-7 mol·L-1 | D.1×10-13 mol·L-1 |
少量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的 ( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.⑤⑦⑧ |
下列措施或事实不能用勒沙特列原理解释的是()
| A.滴加酚酞的氨水中加入氯化铵固体后红色变浅 |
B.棕红色的NO2加压后颜色先变深后变浅(已知: 2NO2 (g) 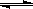 N2O4 (g)) N2O4 (g)) |
| C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 |
| D.煅烧粉碎的硫铁矿利于SO2的生成 |
NA为阿伏加德罗常数,且已知C2H2(g)+ 5/2O2(g)=2CO2(g)+H2O(l)
△H=-1300kJ·mol-1, 则下列说法正确的是()
| A.当有20NA个电子转移时,放出2600kJ 热量 |
| B.当有4 NA个碳氧共用电子对生成时,放出1300kJ热量 |
| C.若生成NA个水蒸气分子焓变为△H’,则△H’<△H |
| D.上述反应为吸热反应 |
有以下两个反应:C+CO2 2CO;(正反应为吸热反应;反应速率为v1),
2CO;(正反应为吸热反应;反应速率为v1),
N2+3H2 2NH3;(正反应为放热反应;反应速率为v2),当温度升高时,v1和 v2的变化情况为( )
2NH3;(正反应为放热反应;反应速率为v2),当温度升高时,v1和 v2的变化情况为( )
| A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |