设NA为阿伏加德罗常数,下列叙述中正确的是
| A.3molNO2气体溶于足量水中充分反应转移的电子总数为2NA |
| B.7.8g Na2O2固体中含有的离子总数为0.4NA |
| C.标准状况下,11.2L的SO3与足量水充分反应生成的溶液中H+的总数为NA |
| D.0.5molNa在适量的氧气中燃烧生成Na2O2和Na2O,得到的电子总数为0.5NA |
将足量NO2通入下列各溶液中,所含离子还能大量共存的是
A.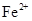 、CH3COOˉ、 、CH3COOˉ、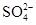 、 、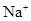 |
B.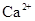 、 、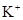 、 、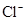 、 、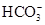 |
C.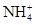 、 、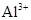 、 、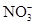 、 、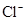 |
D.K+、Na+、SO32ˉ、AlO2ˉ |
t℃时在VL密闭容器中通入a g SO3(g),此时容器内的压强为P ,当反应2SO3(g) 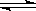 2SO2(g)+O2(g)达到平衡状态时恢复至原温度,压强变为1.25P ,则平衡混合气体的平均相对分子质量为
2SO2(g)+O2(g)达到平衡状态时恢复至原温度,压强变为1.25P ,则平衡混合气体的平均相对分子质量为
| A.40 | B.64 | C.52a | D.30a |
CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是
| A.Cs显+3价,I 、Cl 均显-1价 |
| B.Cs显 +1价,Cl显+1价,I显-1价 |
| C.在CsICl2溶液中通入Cl2 ,有单质碘生成 |
| D.在CsICl2溶液中通入SO2气体,有硫酸生成 |
已知H2(g)+Br2(l)="2HBr(g);" △H= -72kJ·mol-1 蒸发1mol Br2(l)需要吸收的 能
能 量为30kJ,其它相关数据如下表:
量为30kJ,其它相关数据如下表:
| H2(g) |
Br2(g) |
HBr(g) |
|
| 1mol分子中的化学键断裂时需吸收的能量/kJ |
436 |
a |
369 |
则表中a为
A.404 B.260 C.230 D.200
下列说法不正确的是
①将SO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②将盐酸、KSCN 溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含 有SO
有SO
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等
⑤使用明矾可以对水进行消毒、杀菌
| A.只有② | B.①②③⑤ | C.①③④⑤ | D.①②③④ |