如图所示:丁可能是强酸也可能是强碱。
(1)若丙是潜艇的供氧剂,请写出甲与水反应的离子方程式 ;若等物质的量的甲,乙,丙,丁的固体投入到足量且等量的水中完全反应所得溶液的质量分数由大到小的顺序是 (用化学式表示)。
(2)若乙是能使品红溶液褪色的气体,请写出乙→丙的化学反应方程式 ;请写出乙可使氯水褪色的离子方程式__________________________.
(3)若甲可作为制冷剂,请写出甲→乙的化学反应方程式 ;将等量的铜粉分别与过量浓的丁溶液、稀的丁溶液反应,消耗丁的物质的量:前者 后者,反应中转移的电子总数:前者 后者(填“>”、“=”或“<”)
在NH3、H2、N2、O2、SO2、NO2、Cl2等七种气体中:
(1)比空气密度小的气体是;
(2)有刺激性气味的气体是;
(3)有颜色的气体是;
(4)水溶液呈碱性的气体是;
(5)常用作氧化剂的气体是;
(6)常用作还原剂的气体是;
(7)能用排水法收集的气体是;
(8)能与水反应,且在反应中既做氧化剂又做还原剂的气体是。
已知甲、乙、丙是三种常见的单质,且组成它们的元素核电荷数之和为35;A-G是七种常见化合物:上述各物质间的相互转化关系如下图所示(反应条件和其它生成物略)。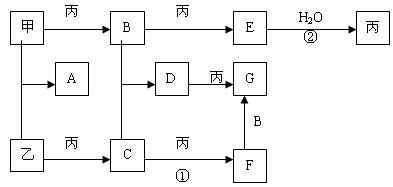
试回答:
(1)B的化学式是:______,D的名称是_________;
(2) 写出①、②两步变化的化学方程式:
有一瓶澄清的溶液,其中可能含NH4+、K+、Na +、Mg2+、Ba2+、 Al3+、 Fe3+、SO42-、CO32-、NO3-、Cl-、I-,取该溶液进行如下实验:
⑴用pH试纸检验,表明溶液呈强酸性;
⑵取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
⑶取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
⑷取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑸将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:在溶液中肯定存在的上述离子有 ,肯定不存在的上述离子有 ,还不能确定是否存在的上述离子有 。
汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1) 写出一氧化碳与一氧化氮反应的化学方程式:。
(2) “催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是
。
(3) 控制城市污染源的方法可以有(多选扣分)
| A.开发氢能源 | B.使用电动车 | C.植树造林 | D.戴上呼吸面具 |
某次采集酸雨样品,每隔一段时间测定一次pH,得到数据如下
| 时间 |
开始 |
8小时 |
16小时 |
24小时 |
32小时 |
40小时 |
48小时 |
| pH |
5.0 |
4.8 |
4.5 |
4.3 |
4.2 |
4.0 |
4.0 |
(1)放置时,雨水样品pH变化的主要原因。
(2)pH变化的离子方程式: