用铜电极电解CuSO4溶液,下列说法正确的是
| A.溶液的酸性增强 |
| B.电极产物为铜和氧气 |
| C.阳极质量减小,阴极质量增加 |
| D.加入氧化铜可使溶液恢复到原状态 |
25℃时,向10mL 0.01mol/L KOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的是
| A.pH>7时,c(C6H5O﹣)>c(K+)>c(H+)>c(OH﹣) |
| B.pH<7时,c(K+)>c(C6H5O﹣)>c(H+)>c(OH﹣) |
| C.V=10mL时,c(K+)=c(C6H5O﹣)>c(OH﹣)=c(H+) |
| D.V=20mL时,c(C6H5O﹣)+c(C6H5OH)=2c(K+) |
下列过程或现象与盐类水解无关的是
| A.可用碳酸钠与醋酸制取少量二氧化碳 |
| B.NaHCO2与Al2(SO4)3混合泡沫灭火剂 |
| C.配制氯化铁溶液时加入少量的盐酸 |
| D.实验室用饱和的FeCl3溶液制取氢氧化铁胶体 |
将下列物质溶于水,能够促进水的电离的是
① NaHSO4 ② NaHSO3 ③ CH3COOH ④ CH3COONa ⑤ NaHCO3 ⑥ NaClO ⑦ NH4HCO3
| A.②④⑤⑥ | B.④⑤⑥⑦ | C.①②③ | D.②④⑤⑥⑦ |
已知0.1mol・L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是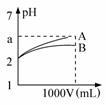
A.a=5时,A是强酸,B是弱酸;
B.若A、B都是强酸,则5>a>2;
C.稀释后,A酸溶液的酸性比B酸溶液强;
D.A、B两种酸溶液的物质的量浓度一定相等。