下列实验不能达到目的的是
| A.用湿润红色石蕊试纸检验氨气 |
| B.用湿润的淀粉-KI试纸检验氯气 |
| C.向浓盐酸中滴加浓硫酸获得少量HCl气体 |
| D.用加热的方法除去氯化铵中的碘 |
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于3 区域的是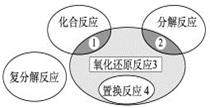
| A.Cl2+2KBr |
B.2NaHCO3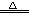 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O |
| D.2Na2O2+2CO2 |
归纳与推理是化学学习常用的方法。下列推理正确的是
| A.因为稀硫酸能与铁反应放出H2,所以浓硫酸与铁反应也一定能放出H2 |
| B.因为Na可以与水反应放出H2,所以K也可以与水反应放出H2 |
| C.因为CO2的水溶液可以导电,所以CO2是电解质 |
| D.因为SO2可以使酸性KMnO4溶液褪色,所以SO2具有漂白性 |
下列有关化学用语和表述正确的是:
| A.元素铯的两种核素137Cs比133Cs多4个质子 |
B.S2-的结构示意图: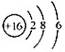 |
| C.质子数为53,中子数为78的碘原子:131 53I |
| D.决定核素种类的微粒数是质子数 |
下列关于胶体说法正确的是
| A.胶体是纯净物 |
| B.胶体、溶液和浊液的本质区别是能否产生丁达尔现象 |
| C.胶体不带电荷 |
| D.胶体分散质粒子的直径在10-9~10-7μm之间 |
下列溶液中的氯离子浓度与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是
| A.150 mL 3 mol·L-1的KClO3 |
| B.75 mL 2 mol·L-1的NH4Cl |
| C.150 mL 2 mol·L-1的CaCl2 |
| D.350 mL 3 mol·L-1的NaCl |