(6分)将12.4g钠和过氧化钠混合物完全溶于水中得100mL溶液,所收集的气体在一定条件下恰好完全反应,则所得溶液的物质的量浓度是多大?(写出计算过程)
将一块表面已被氧化成氧化钠的钠块投入水中,完全反应后收集到气体224mL(标准状况),得到100mL溶液,向上述溶液中逐滴滴加1mol•L-1的稀盐酸30mL恰好完全中和。(1)写出钠与水发生反应的离子方程式,并标出电子转移的方向和数目。(2)计算所得NaOH溶液的物质的量浓度。(3)求钠块中氧化钠的质量分数。(请写出计算过程。)
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生可逆反应:N2(g)+3H2(g) ="====" 2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%,计算平衡时N2 的转化率。
已知硫酸银的溶解度较小,25℃时,每100 g水仅溶解0.836 g。硫酸钡、AgCl的溶解度太小,忽略不计。(该题 结果均保留三位有效数字)
结果均保留三位有效数字)
(1) 25℃时,在烧杯中放入6.24 g硫酸银固体,加200 g水,经充分溶解后,所得饱和溶液的体积为200 mL。计算溶液中Ag+的物质的量浓度。
(2) 若在(1)题烧杯中加入50 mL 0.0268 mol/L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3) 在(1)题烧杯中需加入多少升0.0268 mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol/L?
把0.8 mol X 气体和0.4 mol Y 气体混合于2 L密闭容器中,使它们发生如下反应:2 X(g)+ Y (g)  n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度。
(3)化学反应方程式中n 值是多少?
CO、CH4均为常见的可燃性气体
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比为
(2)已知在101kpa时,CO的 燃烧热为283KJ/mol。相同条件下,若2 molCH4燃烧生成液态水,所放出的热量为1mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是
燃烧热为283KJ/mol。相同条件下,若2 molCH4燃烧生成液态水,所放出的热量为1mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是
(3)120℃、101Kpa下,a ml 由 CO、CH4组成的混合气体在b ml O2中完全燃烧后,恢复到原温度和压强。
CO、CH4组成的混合气体在b ml O2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生b ml CO2,则混合气体中CH4的体积分数为(保留2位小数)
②若燃烧后气体体积缩小了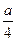 ml,则a与b关系的数学表达式是
ml,则a与b关系的数学表达式是