空气吹出法工艺,是目前“海水提溴”的最主要方法之一 。其工艺流程如下:
。其工艺流程如下:
(1)溴在周期表中位于周期,族。
(2)步骤④的离子方程式:。
(3)已知溴的沸点是58.5℃,步骤⑥的蒸馏过程中,溴出口温度为何要控制在80—90℃。温 度过高或过低都不利于生产 ,请解释原因:。
度过高或过低都不利于生产 ,请解释原因:。
(4)步骤⑧中溴蒸气冷凝后 得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。若在实验室分离上述混合物的分离仪器的名称是,分离时液溴从分离器的(填“上口”或“下口”)排出。
得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。若在实验室分离上述混合物的分离仪器的名称是,分离时液溴从分离器的(填“上口”或“下口”)排出。
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”: 。
。
有一混合物的水溶液,只可能含有以下离子中的若干种:K+、 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、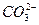 、
、 ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g, 经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测错误的是
经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测错误的是
| A.K+一定存在 |
B.50mL溶液中含0.01mol 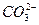 |
| C.Cl-可能存在 |
| D.Ba2+一定不存在,Mg2+可能存在 |
图中曲线粗略表示原子序数在前18号中的某些元素的原子序数(按递增顺序连续排列)和相应单质沸点的关系,其中A点表示的元素是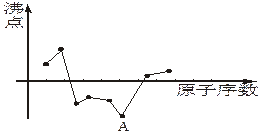
| A.C | B.Na | C.Ne | D.N |
已知:O2(g) = O2+(g)+e- H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1
PtF6-(g) =PtF6(g)+e-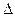 H2=" +771.1" kJ·mol-1
H2=" +771.1" kJ·mol-1
O2+(g)+PtF6-(g) =O2PtF6(S)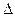 H3=" -482.2" kJ·mol-1
H3=" -482.2" kJ·mol-1
则反应O2(g)+PtF6(g) = O2PtF6 (s)的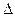 H是
H是
| A.77.6 kJ | B.-77.6 kJ·mol-1 | C.+77.6kJ·mol-1 | D.-886.8kJ·mol-1 |