一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2
 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
| A.1.0体积的N2和3.0体积的H2 |
| B.2.0体积的N2、6.0体积的H2和4.0体积的NH3 |
| C.4.0体积的NH3和1.0体积的H2 |
| D.2.0体积的NH3 |
某实验小组学生按照课本实验要求,用50 mL 0.5 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量计算中和热。下列说法正确的是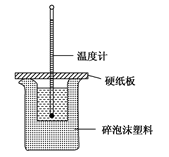
| A.实验过程中没有热量损失 |
| B.图中实验装置缺少环形玻璃搅拌棒 |
| C.烧杯间填满碎泡沫塑料的作用是固定小烧杯 |
| D.酸或碱的物质的量越大,所测中和热的数值越大 |
下列热化学方程式书写正确的是( )
| A.C+H2O===CO+H2ΔH=+131.3 kJ·mol-1 |
B.H2(g)+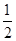 O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1 O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1 |
| C.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ |
| D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1 |
化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是( )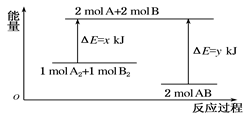
该反应是吸热反应
断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C.断裂2 mol A—B键时需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
下列叙述正确的是( )
| A.同温同压下,4Al(s)+3O2(g)===2Al2O3(s)在常温和点燃条件下的ΔH不同 |
| B.在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应放热,ΔH>0 |
C.已知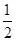 C(s)+ C(s)+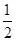 O2(g)=== O2(g)===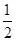 CO2(g) CO2(g)ΔH=-196.8 kJ·mol-1,则碳的燃烧热是ΔH=-196.8 kJ·mol-1 |
| D.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) |
ΔH=-57.4 kJ·mol-1,则含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的能量
同温同压下,下列热化学方程式中Q值最大的是(均为放热反应)( )
| A.2A(l)+B(l)==="2C(g)" ΔH=-Q1 kJ/mol |
| B.2A(g)+B(g)==="2C(g)" ΔH=-Q2 kJ/mol |
| C.2A(g)+B(g)==="2C(l)" ΔH=-Q3 kJ/mol |
| D.2A(l)+B(l)==="2C(l)" ΔH=-Q4 kJ/mol |