根据下列有关图象,说法正确的是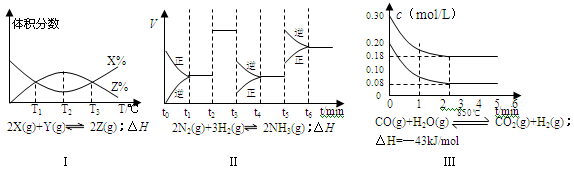
| A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 |
| B.由图Ⅱ知,反应在t6时,NH3体积分数最大 |
| C.由图Ⅱ知,t3时采取降低反应温度的措施 |
| D.图Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量 |
某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位。阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是()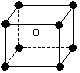
| A.1∶8 | B.1∶4 | C.1∶2 | D.1∶1 |
下列物质中,难溶于CCl4的是()
| A.碘单质 | B.水 | C.苯 | D.甲烷 |
在酸性条件下可以发生水解反应生成X、Y两种不同物质,而且X、Y两种物质的相对分子量相同,这种有机物可能是()
| A.乙酸乙酯 | B.乙酸甲酯 | C.甲酸丙酯 | D.甲酸乙酯 |
把质量为mg的铜丝灼烧变成黑色,立即放入下列物质中,使铜丝变成红色,而且质量仍为mg的是()
| A.稀H2SO4 | B.C2H5OH | C.CH3COOH溶液 | D.盐酸 |
白酒、食醋等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是()①检验自来水中是否含氯离子②鉴别食盐和小苏打
③蛋壳能否溶于酸④白酒中是否含甲醇
| A.①② | B.①④ | C.②③ | D.③④ |