下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
(1)通入乙醇(C2H5OH)的惰性电极的电极反应式为 。
若甲池可以充电,充电时A接电源的负极,此时B极发生的电极反应式为 。
(2)在乙池反应过程中,可以观察到 电极周围的溶液呈现棕褐色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色,C极发生的电极反应 。
(3)若在常温常压下,1gC2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为 。
某一反应体系中,有反应物和生成物共五种物质,这五种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中Cl2、H2O均为生成物。
(1)该反应中的氧化剂是,氧化产物为。
(2)该反应中,氧化产物与还原产物的物质的量之比为。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中转移电子的数目为NA(NA表示阿伏伽德罗常数的值),发生反应的KMnO4的质量为g。
化学科学在药物的开发、合成和使用中起着至关重要的作用。如小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,硫酸亚铁可补铁、防治贫血。试回答下列问题:
(1)写出小苏打与胃酸(主要成分为稀盐酸)作用的离子方程式:。
(2)自选合适的氧化剂,将补铁剂中的Fe2+氧化成Fe3+,写出相关的离子反应方程式:____________________。
(3)检验Fe3+常用的试剂除碱外,还可以用(填化学式),现象是。
无机化合物可根据其组成和性质进行分类: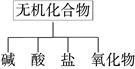
(1)右图所示的物质分类方法名称是 ;
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面;(只需填一种)
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
①HCl ② |
③ ④Ba(OH)2 |
⑤Na2CO3 ⑥ |
⑦CO2 ⑧Na2O2 |
(3)写出⑦转化为⑤的离子方程式;
(4)呼吸面具中用⑧作为O2来源的反应原理为(用化学反应方程式表示)、;
( 14分)(1)3.6克H2O的物质的量是,含有个H2O,含有molH。
(2)3.01×1023个OH—的物质的量为,质量为,含有质子的物质的量为,含有电子的物质的量为。
某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。
(1)该小组同学采用了以下操作制备胶体,请将空白处填写完整。
取一个烧杯,加入20mL蒸馏水,加热至沸腾,然后向烧杯中滴加5~6滴饱和_______ ___溶液,继续煮沸,至出现_________后,停止加热;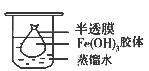
(2)将制得的胶体放入半透膜制成的袋内,如上左图所示,放置2min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察(填写“有”或“无”)_________ 丁达尔现象:再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为______________________________;
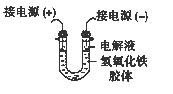
(3)将半透膜内的液体倒入U 型管中,如上右图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是(填“阴”或“阳”)_____极附近颜色逐渐变深,其原因是_____________________________________。