能正确表示下列化学反应的离子方程式的是
| A.氢氧化钡溶液与盐酸的反应 OH-+H+= H2O |
| B.澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H+ = Ca2+ +2H2O |
| C.铜片插入硝酸银溶液中 Cu + Ag+ = Cu2+ + Ag |
| D.碳酸钙溶于稀盐酸中 CO32-+2H+=Ca2++H2O+CO2 |
下列反应的离子方程式正确的是
| A.次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+ H2O +CO2=CaCO3↓+2HClO |
| B.硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+=Fe3++4H2O |
| C.Fe2(SO4)3的酸性溶液中通入足量硫化氢 Fe3++H2S=Fe2++S↓+2 H+ |
| D.氯化亚铁溶液中加入稀硝酸 3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
下列说法中正确的是
| A.CH3CH2OH、SO3和水分别属于非电解质、强电解质和弱电解质 |
| B.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
| C.煤油可由石油分馏获得,可用于保存少量金属钠 |
| D.工业上金属Mg、Al都是用电解其相应的氯化物水溶液制得的 |
下图表示某有机反应过程的示意图,该反应的类型是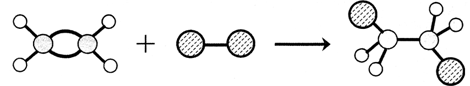
| A.加成反应 | B.取代反应 | C.聚合反应 | D.酯化反应 |
某实验需要使用大约480mL 1mol/L的稀H2SO4,现若要你用18.4mol/L的浓H2SO4配制,则你需量取浓H2SO4的体积是
| A.26.1mL | B.27.2mL | C.26.0m L | D.27.0mL |
节能减排是构建和谐社会的重大举措。下列举措不符合这一要求的是
| A.自2008年6月1日起,实行塑料购物袋有偿使用 |
| B.包装盒、快餐盒等全部用聚苯乙烯生产,以减少木材的使用 |
| C.农村大力发展沼气,将废弃的秸杆转化为清洁高效的能源 |
| D.推广使用乙醇汽油作汽车燃料 |