用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为
| A.0.2mol | B.0.4mol | C.0.6mol | D.0.8mol |
将19.2g的铜屑投入到400mL浓度均为0.5mol.L﹣1HNO3和H2SO4的混合溶液中,当转移0.45mol电子时溶液增加的质量为
| A.4.5g | B.9.9g | C.13.2g | D.14.7g |
下列叙述中,正确的是
| A.二氧化硫的摩尔质量是64g |
| B.一个镁的原子质量就是镁的相对原子质量 |
| C.水的相对分子质量等于18g |
D.一个16O的实际质量约等于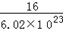 g g |
下列关于摩尔的叙述,正确的是
| A.摩尔是代表微观粒子多少的物理量 |
| B.摩尔是物质的量的单位 |
| C.摩尔是粒子数与阿伏伽德罗常数之比 |
| D.摩尔是描述宏观物质多少的单位 |
下列离子方程式不正确的是
| A.醋酸溶液中加入少量氢氧化镁固体:Mg(OH)2+2CH3COOH═Mg2++2CH3COO﹣+2H2O |
| B.H2O2溶液中加入足量酸性KMnO4溶液:2MnO4﹣+3H2O2+6H+═2Mn2++6H2O+4O2↑ |
| C.Ca(HCO3)2溶液中加入足量澄清石灰水:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O |
| D.NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42﹣恰好沉淀完全:NH4++H++SO42﹣+Ba2++2OH﹣=NH3•H2O+BaSO4↓+H2O |
化学与数学有密切的联系,将某些化学知识用数轴表示,可以受到直观形象、简明易记的良好效果.(注:[Al(OH)4]-即AlO2-)下列用数轴表示的化学知识中错误的是
A.分散系的分类分散系微粒直径(nm) |
B.AlCl3溶液中滴加NaOH溶液后Al元素的存在形式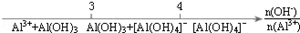 |
C.铁与稀硝酸反应后溶液中铁元素的存在形式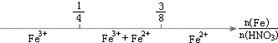 |
D.Na与O2反应的产物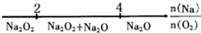 |