在t℃下,某反应达到平衡,平衡常数K=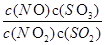 。恒容时,温度升高,NO浓度减小。下列说法正确的是
。恒容时,温度升高,NO浓度减小。下列说法正确的是
| A.升高温度,逆反应速率减小 |
B.该反应化学方程式为:NO+SO3 NO2+SO2 NO2+SO2 |
| C.该反应的焓变为正值 |
| D.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度 |
下列各组物质之间通过一步就能实现如图所示转化的是
| 物质编号 |
物质转化关系 |
a |
b |
c |
d |
| ① |
 |
Na2O |
Na2O2 |
Na |
NaOH |
| ② |
Al2O3 |
NaAlO2 |
Al |
Al(OH)3 |
|
| ③ |
FeCl2 |
FeCl3 |
Fe |
CuCl2 |
|
| ④ |
NO |
NO2 |
N2 |
HNO3 |
A.①② B.②③. C.②④ D.①③
下列指定反应的离子方程式正确的是
| A.氯化铝溶液中加入过量的氨水:Al3++4 NH3·H2O=AlO2-+4 NH4+ |
| B.稀硝酸中加入过量铁粉:Fe+4H++NO3- = Fe3++NO↑+2H2O |
| C.二氧化锰与浓盐酸混合加热:MnO2+4H++2Cl-△Mn2++ Cl2↑+2H2O |
| D.石灰水中加入过量小苏打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
设NA为阿伏加德罗常数的值。下列说法正确的是()
| A.标准状况下,2.24 L水中所含的电子数为NA |
| B.常温常压下,16 g O3所含的电子数为8NA |
| C.0.1 mol Na2O2晶体中所含的离子数为0.4NA |
| D.1 mol Fe在氧气中充分燃烧失去的电子数为3NA |
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是
| A.灼烧 | B.过滤 | C.分液 | D.蒸馏 |
下列关于物质性质与应用的说法正确的是()
| A.碳具有还原性,高温条件下能将二氧化硅还原为硅 |
| B.二氧化硫有漂白、杀菌性能,可在食品加工中大量使用 |
| C.二氧化硅是半导体材料,可将太阳能直接转化为电能 |
| D.二氧化锰具有较强的的氧化性,可作H2O2分解的氧化剂 |