NA表示阿伏伽德罗常数。下列叙述中正确的是
| A.标准状况下,22.4 L CCl4中含CCl4分子数为NA |
| B.4.0 g NaOH固体溶于100 mL水中,得到1 mol/L的 NaOH溶液 |
| C.常温常压,5.6 g Fe在足量Cl2中燃烧,转移的电子数为0.3NA |
| D.分子总数为NA的SO2和CO2的混合气体中含有的氧原子数为4NA |
在一定条件下,在体积为2L的密闭容器中发生反应:mA + nB=pC。t秒末,A减少了1 mol,B减少了1.25  mol,C增加了0.25 mol/L。则m ∶ n ∶ p应为()
mol,C增加了0.25 mol/L。则m ∶ n ∶ p应为()
A.4∶ 5∶ 2 B.2∶ 5∶ 4 C.1∶ 3∶ 2 D.3∶ 2∶ 1
设C(g)+CO2(g)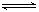 2CO(g) △H>0 ,反应速率为 u1,N2+3H2
2CO(g) △H>0 ,反应速率为 u1,N2+3H2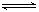 2NH3 △H<0反应速率为 u2,对于上述反应,当温度升高时,u1和u2的变化情况为()
2NH3 △H<0反应速率为 u2,对于上述反应,当温度升高时,u1和u2的变化情况为()
| A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |
用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是( )
| A.c(H+)>c(OH-) | B.c(HCN)<c(CN-) |
| C.c(CN-)+c(OH-)=0.1mol·L-1 | D.c(HCN)+c(CN-) =0.2mol·L—11 |
0.1 mol•L-1 KHS溶液中下列表达式不正确的是( )
| A.c(K +)+c(H+)= c(OH-)+ c(HS-)+2 c(S2-) | B.c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+) |
| C.c(HS-)+ c(S2-)+ c(H2S)=" 0.1" mol•L-1 | D.c(K+)> c(HS-)> c(OH-)> c(H2S)> c (H+) |
将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是( )
| A.Ca(OH)2的溶解度、溶剂的质量 | B.溶液中溶质的质量分数 |
| C.溶液的质量、水的电离平衡 | D.溶液中Ca2+的数目 |