(13分)(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s) + O3(g) = 3Ag2O(s) ΔH1
已知2Ag2O(s) =" 4Ag(s)" + O2(g) ΔH2
则常温下反应: 2O3(g) = 3O2(g)的ΔH= (用ΔH1和ΔH2表示).
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应:
CH4(g) +2NO2(g)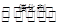 N2(g) +CO2(g) +2H2O(g)
N2(g) +CO2(g) +2H2O(g)
在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) / n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①写出该反应平衡常数的表达式K = 。
②若温度不变,提高[n(NO2) / n(CH4)]投料比,则NO2的平衡转化率 。(填“增大”、“减小”或“不变”。)
③由上表可知该可逆反应的正反应是 反应。
④400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数 。
(3)下图为连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图。则NiO电极上NO发生的电极反应式为: 。
(4分)在同温同压下,两个体积相同的玻璃容器中分别盛满O3和O2 ,容器中的O3和O2的质量之比为,密度之比为。
9g水的物质的量是mol,含个氧原子,mol氢原子。
1mol氧气的质量是g,所含分子数是个,在标况下的体积是L。
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
|
| Z |
W |
请回答下列问题:
(1)元素Z位于周期表中第______________周期,___________族;
(2)XW2的电子式为_______________;
(3)Y的最高价氧化物的化学式为________________;
(4)W和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________。
A~H及X均为中学化学常见物质,X是一种金属单质,A、B是周期表中相邻元素,且A在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)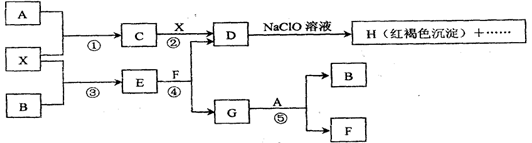
试回答下列问题:
(1)写出 C物质的化学式:。
(2)在上述①~⑤反应中肯定不属于氧化还原反应的是(填编号)。
(3)用离子方程式表示在D溶液中加入NaClO溶液产生红褐色沉淀的原因:
 。
。
(4)请写出C腐蚀铜板制印刷电路板的离子方程式: ____。