下列各组物质中,所含分子数一定相同的是
| A.10gH2和10gO2 | B.5.6LN2和5.6L CO2 |
| C.14g CO和0.5molBr2 | D.标准状况下2.24LH2O和0.1molN2 |
将pH为5的硫酸溶液稀释500倍,稀释后溶液中c (SO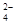 )∶c(H+)约为( )。
)∶c(H+)约为( )。
| A.1∶1 | B.1∶2 | C.1∶10 | D.10∶1 |
一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:
m A(s)+n B(g) p C(g)+q D(g)△H
p C(g)+q D(g)△H
达到平衡后,测得B的浓度为0.5 mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.3mol·L-1。当其它条件不变时,C在反应混合物中的体积分数(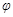 )与温度(T)、时间(t)的关系如下图所示。下列叙述正确的是()
)与温度(T)、时间(t)的关系如下图所示。下列叙述正确的是()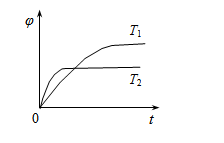
A.热化学方程式中:n<p+q
B.热化学方程式中:△H>0
C.达平衡后,增加A的量,有利于提高B的转化率
D.若T1、T2时反应的平衡常数分别为K1、K2,则K1>K2
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%。现取20 mL pH="3" 的 CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如下图,则加入氨水前CH3COOH的电离度为()
| A.1% | B.1.5% | C.0.5% | D.0.1% |
汽车尾气净化中的一个反应如下:
NO(g)+CO(g)
 N2(g)+CO2(g)△H=-373.4kJ·mol-1
N2(g)+CO2(g)△H=-373.4kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是()
化学反应N2+3H2=2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是( )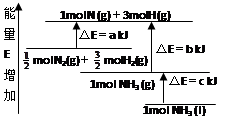
| A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1 |
| B.N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ·mol-1 |
C. N2(g)+ N2(g)+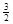 H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1 H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1 |
D. N2(g)+ N2(g)+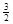 H2(g)=NH3(g); △H=(a+b)kJ·mol H2(g)=NH3(g); △H=(a+b)kJ·mol |