以钛酸亚铁(FeTiO3)为原料制取BaTiO3的过程如下图所示:
(1)FeTiO3与稀硫酸反应,产物有TiOSO4、H2O和 (填化学式)。
(2)已知:TiO2(s)+H2SO4(aq)=TiOSO4(aq)+H2O (l) △H=akJ·mol-1
H2TiO3(s)=TiO2(s)+H2O (l) △H=b kJ·mol-1
写出TiOSO4水解生成H2TiO3的热化学方程式 。
(3)写出TiO2生成BaTiO3的化学方程式 。
酸雨主要是燃烧含硫燃料时释放出的二氧化硫造成的。现将每隔一定时间测定某份雨水的pH记录入表所示。
不同时间测得的pH
| 测试时间/h |
0 |
1 |
2 |
3 |
4 |
… |
8 |
| 雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
… |
4.55 |
请说明在测定的时间里,雨水样品的pH变化的原因。
氮是蛋白质的重要组成成分,动、植物生长都需要吸收含氮的养料。空气中虽然含有大量的氮气,但多数生物不能直接吸收氮气,只能吸收含氮的化合物。在自然界,大豆、蚕豆等豆科植物的根部都有根瘤菌,能把空气中的氮气变成含氮化合物,所以,种植这些植物时不需施用或只需施用少量氮肥。这种将游离态氮转变为化和态氮的方法,叫做氮的固定。
(1)为防治酸雨,降低燃烧时向大气排放的SO2,工业上经常将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫化合物进入大气)反应的化学方程式:_______________________________________、_____________________________________。
(2)用碳酸钙代替生石灰,能否达到类似的效果? ___________。
某校高一研究性学习小组将造成我省某市空气污染的主要原因分为4种:
| A.燃烧农作物秸秆 | B.燃烧含硫煤 |
| C.粉尘污染 | D.机动车尾气污染 |
设计的问题是:你认为造成我市空气污染的最主要的原因是什么?并就此调查了我市100名市民和100位环保部门人士,调查结果如下图所示:
(1)该市市民认为造成我市空气污染的最主要的原因是__________,环保人士认为造成我市空气污染的最主要的原因是________。
(2)上述调查结果说明该市市民对__________造成的空气污染认识不足。该原因造成的大气污染的主要有害成分是_______________,空气中该成分含量较高时,在空气中的氧气和水的共同作用下,会形成酸雾,其化学反应方程式为_____________________________。
有一块Fe、Al合金,将其全部溶于盐酸中,并通人足量的Cl2,再加入过量的NaOH溶液,过滤,将沉淀充分灼烧,得到的固体粉末跟原合金质量相等,求合金中铝的质量分数。
下图表示的是A-E五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。试推出各物质的化学式,并写出B→C、C→D、D→E反应的离子方程式。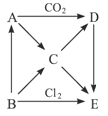
(1)A______B________C_______D________E_________
(2)B→C_______________C→D_________________D→E___________________